碳化硅(SiC) 、氧化铝(Al2O3) 和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途。宇宙火箭和导弹中,大量用钛代替钢铁。
(1)Al的离子结构示意图为 ;
Al与NaOH溶液反应的离子方程式为
(2)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,
其反应方程式为
(3)工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g) + x N2(g) + 6 H2(g)  Si3N4(s) + 12 HCl(g) △H<0
Si3N4(s) + 12 HCl(g) △H<0
在恒温、恒容时,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2 L密闭容器内,进行上述反应,5 min达到平衡状态,所得HCl(g)为0.3mol/L、 N2为0.05 mol/L
① H2的平均反应速率是
② 反应前与达到平衡时容器内的压强之比=
③ 系数 x =
(4)已知:TiO2(s)+2Cl2(g)===TiCl4(l)+O2(g) ΔH1=+140 kJ·mol-1
C(s)+ O2(g)=== CO(g) ΔH2 =-110 kJ·mol-1
O2(g)=== CO(g) ΔH2 =-110 kJ·mol-1
写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:
。
(共10分)(1)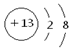 (1分) 2Al +2OH-+2H2O=2AlO2 + 3H2↑ (2分)
(1分) 2Al +2OH-+2H2O=2AlO2 + 3H2↑ (2分)
(2)Si3N4 +16HF=3SiF4 + 4NH4F (2分)
(3)①0.03mol/(L·min) ②11:12 ③x=2 (1分/空,若没有带单位不得分)
(4)TiO2(s)+2Cl2(g)+2 C(s) ===TiCl4(l)+ 2 CO(g) ΔH = - 80 kJ·mol-1(2分)
题目分析:(1)铝离子的核外电子数是8个,所以离子结构示意图为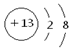 。金属铝能和氢氧化钠溶液反应生成氢气和偏铝酸钠,反应的离子方程式是2Al +2OH-+2H2O=2AlO2 + 3H2↑。
。金属铝能和氢氧化钠溶液反应生成氢气和偏铝酸钠,反应的离子方程式是2Al +2OH-+2H2O=2AlO2 + 3H2↑。
(2)氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,则根据原子守恒可知,该铵盐应该是氟化氨,因此反应的化学方程式是Si3N4 +16HF=3SiF4 + 4NH4F。
(3) 3SiCl4(g) + x N2(g) + 6 H2(g)  Si3N4(s) + 12 HCl(g)
Si3N4(s) + 12 HCl(g)
起始量(mol) 0.3 0.2 0.6 0 0
转化量(mol/L) 0.15 0.05x 0.3 0.05 0.6
平衡量(mol/L) 0.15 0.2-0.05x 0.3 0.05 0.6
则① H2的平均反应速率是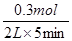 =0.03mol/(L·min)
=0.03mol/(L·min)
② 反应前与达到平衡时容器内的压强之比是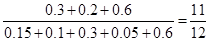
③0.2-0.05x=0.1
解得x=2
(4)根据盖斯定律可知,①+②×2即得到反应TiO2(s)+2Cl2(g)+2 C(s) ===TiCl4(l)+ 2 CO(g),所以该反应的反应热ΔH =140 kJ/mol -110 kJ/mol×2=-80 kJ·mol
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,在注重考查学生基础知识的同时,侧重考查学生灵活运用基础知识解决实际问题的能力。有助于培养学生的逻辑推理能力,和规范的答题能力。
