(7分)(1)已知:H—H键能为436kJ/mol,N≡N键能为945kJ/mol,N—H键能为391kJ/mol。根据键能计算工业合成氨的反应是___________ 反应(填“吸热”或“放热”),消耗1mol N2合成氨反应的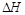 =______________。
=______________。
(2) 现根据下 * * 个热化学反应方程式:
①Fe2O3(s)+3CO(g) =2Fe(s)+3CO2(g) △H=―24.8kJ/mol
②3Fe2O3(s)+ CO(g) =2Fe3O4(s)+ CO2(g) △H=―47.2kJ/mol
③Fe3O4(s)+CO(g) =3FeO(s)+CO2(g) △H=+640.5kJ/mol
则CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式为 。
(1) 放热(2分);-93KJ/mol (2分)
(2)CO (g)+FeO(s)=" Fe(s)+" CO2 (g) △H=-218KJ/mol (3分)
题目分析:(1)因反应热等于反应物的总键能减去生成物的总键能945kJ/mol+3×436KJ/mol-6×391kJ/mol=-93KJ/mol ,通过计算反应的△H大于0为放热反应。(2)所以热化学方程式为-①-②-2×③,即CO (g)+FeO(s)=" Fe(s)+" CO2 (g),△H做相应的计算,△H=-218KJ/mol。
点评:本类题型注意盖斯定律的应用。属于简单题。
