目前工业合成氨的原理是:N2(g)+3H2(g) 2NH3(g) △H=-93.0kJ /mol;另据报道,一定条件下:2N2(g)+6H2O(l)
2NH3(g) △H=-93.0kJ /mol;另据报道,一定条件下:2N2(g)+6H2O(l) 4NH3(g)+3O2(g) △H=" +1530.0kJ" /mol。
4NH3(g)+3O2(g) △H=" +1530.0kJ" /mol。
(1)氢气的燃烧热△H=_______________kJ/mol。
(2)在恒温恒压装置中进行工业合成氨反应,下列说法正确的是 。
A.气体体积不再变化,则已平衡
B.气体密度不再变化,尚未平衡
C.平衡后,往装置中通入一定量Ar,压强不变,平衡不移动
D.平衡后,压缩装置,生成更多NH3(3)在恒温恒容装置中进行合成氨反应,各组分浓度-时间图像如下。
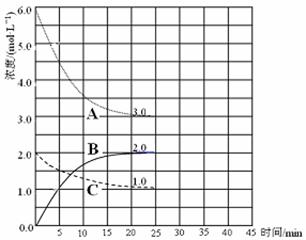
① 表示N2浓度变化的曲线是 。
② 前25 min 内,用H2浓度变化表示的化学反应速率是 。
③ 在25 min末刚好平衡,则平衡常数K = 。
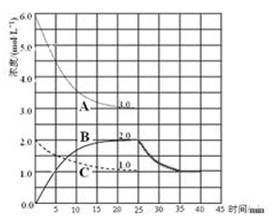
(4)在第25 min 末,保持其它条件不变,升高温度,在第35 min末再次平衡。平衡移动过程中H2浓度变化了1.5 mol·L-1,在图中画出第25 min ~ 40 min NH3浓度变化曲线。
(5)已知常温下,NH4+ 的水解常数为1.0×10-9,则0.1mol/L NH4Cl溶液pH= 。(忽略NH4+水解对NH4+浓度的影响)
(16分)
(1)-286.0 (2分,不写“-”扣1分)
(2)AD (2分)
(3)① C (2分)
② 0.12 mol / (L·min) (3分,数据2分,单位1分)
③ 0.15 (2分)
(4) (3分,起点1分,拐点1分,延长线1分)
(3分,起点1分,拐点1分,延长线1分)
(5) 5 (2分)
题目分析:(1)先将已知两个热化学方程式编号为①②,再根据盖斯定律,将(①×2—②)/3可得:2H2(g)+O2(g)= 2H2O(l) △H=-572.0kJ /mol,最后将系数减半,则焓变随之减半,即H2(g)+O2(g)= 2H2O(l) △H=-286.0kJ /mol;根据燃烧热概念可得,氢气的燃烧热△H=-286.0kJ /mol;(2)恒温恒压下,气体摩尔体积相同,由于n=V/Vm,则气体体积不再变化,就是气体的物质的量不再变化,说明反应已达平衡,故A正确;气体密度等于气体质量除以气体总体积,根据质量守恒定律可知气体质量始终不变,若气体密度不再变化时,则气体总体积不变,气体的物质的量不变,说明反应已达平衡,故B错;平衡后充入惰性气体,维持恒温恒压,必须增大容器容积,减小各组分浓度,其实质是减小压强,平衡向逆反应方向或气体体积增大方向移动,故C错;平衡后,压缩装置,缩小容器容积,其实质是增大压强,平衡向正反应方向或气体体积减小方向移动,故D正确;(3)①合成氨的原理为N2(g)+3H2(g) 2NH3(g),读图可知,前25min内A的浓度由6.0mol/L逐渐减小为3.0mol/L,C的浓度由2.0mol/L逐渐减小到1.0mol/L,B的浓度由0逐渐增大到2.0mol/L,则A、C、B的变化浓度分别为3.0mol/L、1.0mol/L、2.0mol/L,因此A、C、B分别表示氢气、氮气和氨气的浓度随反应时间变化的曲线;②由于前25min内氢气的浓度由6.0mol/L逐渐减小为3.0mol/L,其变化浓度为3.0mol/L,则v(H2)=△c(H2)/△t="3.0mol/L÷25min" ="0.12" mol / (L·min);③根据三行数据法可得:
2NH3(g),读图可知,前25min内A的浓度由6.0mol/L逐渐减小为3.0mol/L,C的浓度由2.0mol/L逐渐减小到1.0mol/L,B的浓度由0逐渐增大到2.0mol/L,则A、C、B的变化浓度分别为3.0mol/L、1.0mol/L、2.0mol/L,因此A、C、B分别表示氢气、氮气和氨气的浓度随反应时间变化的曲线;②由于前25min内氢气的浓度由6.0mol/L逐渐减小为3.0mol/L,其变化浓度为3.0mol/L,则v(H2)=△c(H2)/△t="3.0mol/L÷25min" ="0.12" mol / (L·min);③根据三行数据法可得:
N2(g)+3H2(g) 2NH3(g)
2NH3(g)
各组分的起始浓度/ mol·L-1 2.0 6.0 0
各组分的变化浓度/ mol·L-1 1.0 3.0 2.0
各组分的平衡浓度/ mol·L-1 1.0 3.0 2.0
K=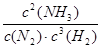 =
=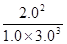 ≈0.15(保留两位有效数字)
≈0.15(保留两位有效数字)
(4)由于合成氨的正反应的△H=-93.0kJ /mol,则正反应是放热反应,升高温度,平衡向吸热反应方向移动,即平衡向逆反应方向移动,则反应物浓度增大,氨气浓度减小,根据三行数据法可得:
N2(g)+3H2(g) 2NH3(g)
2NH3(g)
25min时各组分浓度/ mol·L-1 1.0 3.0 2.0
各组分的变化浓度/ mol·L-1 0.5 1.5 1.0
35min时各组分浓度/ mol·L-1 1.5 4.5 1.0
因此,25min→35min,氨气浓度由2.0mol/L逐渐减小为1.0mol/L;35min→40min,氨气浓度为1.0mol/L,始终保持不变;(5)氯化铵是强酸弱碱盐,其完全电离出的铵根离子部分水解,生成一水合氨和氢离子,存在水解平衡,设溶液中氢离子浓度为xmol/L,由三行数据法可得:
NH4++H2O NH3•H2O+H+
NH3•H2O+H+
各组分的起始浓度/ mol·L-1 0.1 0 0
各组分的变化浓度/ mol·L-1 x x x
各组分的平衡浓度/ mol·L-1 0.1—x x x
K=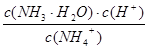 =
=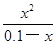 =1.0×10-9
=1.0×10-9
由于铵根离子水解程度很小,则0.1—x≈0.1,则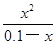 =
=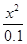 =1.0×10-9,则x 2=1.0×10-10,x=1.0×10-5;由于pH=—lgc(H+)=5。
=1.0×10-9,则x 2=1.0×10-10,x=1.0×10-5;由于pH=—lgc(H+)=5。
