问题
选择题
已知H2(g)+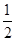 O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1。下列说法中不正确的是 ( )
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1。下列说法中不正确的是 ( )
A.H2的燃烧热为241.8 kJ·mol-1
B.2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1
C.1 mol H2完全燃烧生成液态水放出的热量大于241.8 kJ
D.断开1 mol H2O的化学键吸收的总能量大于断裂1 mol H2和0.5 mol O2的化学键所吸收的总能量
答案
答案:A
题目分析:燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,题中水的状态是气态,不是稳定状态,水的稳定状态应该是液态,A不正确;B正确,由于气态水的能量高于液态水的能量,所以1mol H2完全燃烧生成液态水放出的热量大于241.8 kJ,C正确;反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以D正确,答案选A。
点评:该题是中等难度的试题,也是高考中的常见考点之一。试题注重基础和能力的双向考查,有助于培养学生的逻辑推理能力。该题的关键是明确燃烧热以及反应热的概念,然后结合题意灵活运用即可。
