SO2、NO、NO2、CO都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题。
(1)上述四种气体中直接排入空气时会引起酸雨的有__________(填化学式)。
(2)已知:2SO2(g)+ O2(g)=2SO3(g);△H=-196.6kJ/mol
O2(g)+2NO(g)=2NO2(g);△H=-113.0kJ/mol
①反应:NO2(g) +SO2(g)= SO3(g) +NO(g)的△H=_ kJ/mol。
②一定条件下,将NO2和SO2以体积比1:1置于恒温恒容的密闭容器中发生反应: NO2(g) +SO2(g) SO3(g) +NO(g),
SO3(g) +NO(g),
下列不能说明反应达到平衡状态的是_____(填字母)。
a.体系压强保持不变
b.混合气体的颜色保持不变
c.NO的物质的量保持不变
d.每生成1molSO3的同时消耗1molNO2
(3)CO可用于合成甲醇,其反应的化学方程式为CO(g)+2H2(g)  CH3OH(g)。在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。
CH3OH(g)。在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。
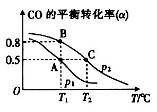
①上述合成甲醇的反应为______(填“放热”或“吸热”)反应。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为___________。
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为_____L。
(4)某研究小组设计了如图所示的甲醇燃料电池装置。
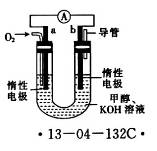
①该电池工作时,OH-向______(填“a”或“b”)极移动。
②电池工作一段时间后,测得溶液的pH减小,则该电池总反应的离子方程式为__________________。
(14分)
(1)SO2、NO、NO2 (2分);
(2)①-41.8(2分) ②ad(1分)
(3)①放热(1分) ②KA=KB>KC(2分)③2(2分)
(4)①b(1分) ②2CH3OH+3 O2+4OH-="2" CO2- 3 + 6H2O(2分)
题目分析:
(1)SO2、NO、NO2直接排入空气时会引起酸雨。
(2)①根据盖斯定律,给出两式相加在两边同时除以2可得目标方程式:NO2(g) +SO2(g)= SO3(g) +NO(g)的△H=[-196.6kJ/mol+(-113.0kJ/mol)]/2=-41.8 kJ/mol。②方程式两边气体分子数相同,压强不能说明是否平衡,a错;必须取正逆反应速率比较,d错。
(3)①根据图像温度升高CO的平衡转化率下降,所以为放热反应。②平衡常数只与温度有关,放热反应温度升高,平衡常数越小,所以KA=KB>KC。
③对于反应CO(g)+2H2(g)  CH3OH(g),第一次状态A建立平衡,转化率为0.5
CH3OH(g),第一次状态A建立平衡,转化率为0.5
始态 10mol 20mol 0
转化量 5mol 10mol 5mol
终态 5mol 10mol 5mol 气体总物质的量为20mol
第二次在B状态建立平衡时
CO(g)+2H2(g)  CH3OH(g),转化率为0.8
CH3OH(g),转化率为0.8
始态 10mol 20mol 0
转化量 8mol 16mol 8 mol
终态 2mol 4mol 8mol 气体总物质的量为14mol
根据相同温度、压强时气体体积比等于物质的量之比,可知答案为7L.
(4)①电池中阴离子移向负极(b极);②2CH3OH+3O2+4OH-="2" CO2- 3 + 6H2O。
