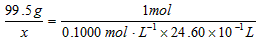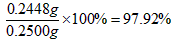One Friday morning, Andrew announced to his wife that he finally decided to ask his boss for a salary raise. All day Andrew felt worried --- what if Mr. Larchmont refuses to grant his request? Andrew had worked so hard and of course, he deserves a wage increase.
The thought of walking into Larchmont’s office left Andrew weak in the knees. Late in the afternoon he finally mustered up the courage to approach his superior. To his delight and surprise, the ever-frugal Harvey Larchmont agreed to give him a raise!
Andrew arrived home to a beautiful table set with their best china, and candles lit. His wife, Tina had prepared a fine meal including his favorite dishes. Immediately he figured someone from the office might have broken the good news to her!
Next to his plate Andrew found a lettered note, reading: "Congratulations, my love! I knew you'd get the raise! I prepared this dinner to show just how much I love you. I am so proud of your accomplishments!" He read it and stopped to reflect on how sensitive and caring Tina was.
After dinner, Andrew was on his way to the kitchen when he observed a second card had slipped out of Tina's pocket onto the floor. He picked it up. He read: "Don't worry about not getting the raise! You deserve it anyway! You are a wonderful provider and I prepared this dinner to show you just how much I love you even though you did not get the increase."
Suddenly tears swelled in Andrew's eyes. Total acceptance! Tina's support for him was not conditional upon his success at work.
The fear of rejection is often softened when we know someone loves us regardless of our success or failure.
小题1:Why was Andrew worried about asking for a salary raise?
A.He was afraid of being turned down.
B.He didn’t think he ought to get a raise.
C.He wife didn’t support him in this.
D.His superior had refused him once.小题2:What does the underlined word “muster” in the second paragraph probably mean?
A.To gather something.
B.To make use of something .
C.To create something.
D.To consume something小题3:Andrew felt ______ when he discovered the truth.
A.angry
B.disappointed
C.relaxed
D.moved小题4:Tina prepared a good meal, _________.
A.because she knew her husband would make it
B.because she wanted to comfort her husband
C.but she didn’t know what the result would be
D.and she wrote a letter to her husband.