问题
填空题
(1)已知下列两个热化学方程式:
C3H8(g)+5O2(g) =3CO2(g)+4H2O(l) ΔH=-2220.0 kJ·mol-1
H2O(l)=H2O(g) ΔH="+44.0" kJ·mol-1
则0.5 mol丙烷燃烧生成CO2和气态水时释放的热量为___________ 。
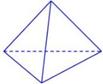
(2)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如下图所示),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________ kJ能量。
N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________ kJ能量。
(3)阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池总反应为:
2H2+O2=2H2O,电解质溶液为稀H2SO4溶液,电池放电时是将_________能转化为___________能。其电极反应式分别为:
负极_________________________,正极_____________________________。
答案
(1) 1022kJ (2) 724kJ (3)化学能转化为 电能 负 极2H2-4e-==4H+,正极 O2+4e-+4H+= 2H2O
题目分析:(1)利用盖斯定律可以推出C3H8(g)+5O2(g) 3CO2(g)+4H2O(g) ΔH=-2044.0 kJ·mol-1.(2)反应前后能量的变化为生成物键能总和减去反应物键能总和=2*941-4*193=724 (3)原电池是将化学能转变为电能两极反应为负 极2H2-4e-==4H+,正极 O2+4e-+4H+= 2H2O
