黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其燃烧产物为SO2和Fe2O3。
(1)已知1g FeS2完全燃烧放出7.1kJ热量,则表示FeS2完全燃烧反应的热化学方程式为:
______________________________________________________________。
(2)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g) 2SO3(g) 在一定条件下达到平衡,测得c(SO3)=0.040mol/L。则该条件下反应的平衡常数K的数值为___________,SO2的平衡转化率为__________。
2SO3(g) 在一定条件下达到平衡,测得c(SO3)=0.040mol/L。则该条件下反应的平衡常数K的数值为___________,SO2的平衡转化率为__________。
(3)当该反应处于平衡状态时,欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是 。(填字母)
A.向平衡混合物中充入Ar
B.向平衡混合物中充入O2
C.改变反应的催化剂
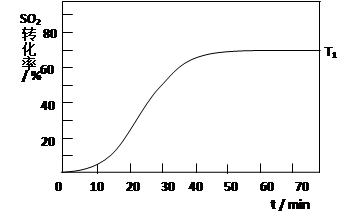
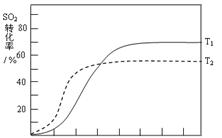
D.降低反应的温度(4)反应:2SO2(g)+O2(g) 2SO3(g) △H<0 , SO2的转化率在起始温度T1=673K下随反应时间(t)的变化如下图,其他条件不变,仅改变起始温度为T2=723K,请在图中画出温度T2下SO2的转化率随反应时间变化的预期结果示意图。
2SO3(g) △H<0 , SO2的转化率在起始温度T1=673K下随反应时间(t)的变化如下图,其他条件不变,仅改变起始温度为T2=723K,请在图中画出温度T2下SO2的转化率随反应时间变化的预期结果示意图。
(1)4FeS2(s)+11O2(g) 2Fe2O3(s)+8SO2(g) △H=-3408kJ/mol (2分)
2Fe2O3(s)+8SO2(g) △H=-3408kJ/mol (2分)
(2)K=1.6×103(2分) 80% (2分) (3)B(1分,多选不得分)
题目分析:(1)FeS2完全燃烧燃烧的化学方程式是4FeS2+11O2 2Fe2O3+8SO2,由于1g FeS2完全燃烧放出7.1kJ热量,则4molFeS2完全燃烧放出的热量是7.1kJ×120×4=3408kJ,所以该反应的热化学方程式是4FeS2(s)+11O2(g)
2Fe2O3+8SO2,由于1g FeS2完全燃烧放出7.1kJ热量,则4molFeS2完全燃烧放出的热量是7.1kJ×120×4=3408kJ,所以该反应的热化学方程式是4FeS2(s)+11O2(g) 2Fe2O3(s)+8SO2(g) △H=-3408kJ/mol。
2Fe2O3(s)+8SO2(g) △H=-3408kJ/mol。
(2) 2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
起始浓度(mol/L) 0.050 0.030 0
转化浓度(mol/L) 0.040 0.020 0.040
平衡浓度(mol/L) 0.010 0.010 0.040
所以该温度下平衡常数K=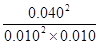 =1600
=1600
SO2的平衡转化率=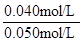 ×100%=80%
×100%=80%
(3)向平衡混合物中充入Ar,容器容积不变,浓度不变,反应速率和平衡状态不变,A不正确;向平衡混合物中充入O2,增大反应物的浓度,反应速率增大,平衡向正反应方向移动,B正确;改变反应的催化剂平衡状态不变,C不正确;降低反应的温度,平衡向正反应方向移动,但反应速率降低,D不正确,答案选B。
(4)温度高反应速率快,到达平衡的时间减少。由于正反应是放热反应,所以温度高不利于平衡向正反应方向进行,SO2的转化率降低,因此正确的图像是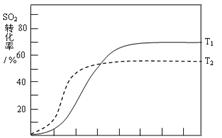 。
。
点评:该题是高考中的常见考点和题型,属于中等难度试题的考查,试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力,提升学生的学科素养。
