阅读理解。
Don't have enough time or money to visit the World Expo (世界博览会) in Shanghai? Don't worry.
Check the official website, Expo Online, at www.expo2010.cn. Without spending any money, you'll feel
like you're enjoying the best of Shanghai.
Expo Online has two main parts. One is a site tour. It shows you a virtual (虚拟的) park with the same
settings as the real Expo. Moving the mouse, you can look at the 3D pavilions (展馆) from every angle (角度). Online, you won't have to pay to enter and enjoy the pavilions. Haibao, the mascot, will guide you and explain
what you're seeing in either Chinese or English.
The other part of the website, Expo Carnival (狂欢节), allows you to rebuild the pavilions and play games
with Haibao. You can also upload your photos, videos and diaries there.
The Web offers lots to see and do, and you don't even have to leave home. Why not check it out?
1. How many main parts does "Expo Online" have?
A. Two.
B. Three.
C. Four.
2. What's the mascot of Expo 2010?
A. Nini.
B. Haibao.
C. Huanhuan.
3. What's the Chinese meaning of the underlined word "upload"?
A. 购买
B. 下载
C. 上传
4. Which of the following is TRUE according to the passage?
A. You can visit the Expo 2010 online without spending any money.
B. Expo Carnival allows you to play games with a mouse.
C. The mascot can explain what you're seeing in three languages.
5. Which of the following is the best title for the passage?
A. Make Enough Money for the World Expo
B. Go to Shanghai to Visit the World Expo
C. Visit the World Expo from your Home
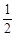 O2(g)=ZnO(s) △H =-351.1kJ·mol-1
O2(g)=ZnO(s) △H =-351.1kJ·mol-1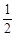 O2(g)=HgO(s) △H =-90.7 kJ·mol-1
O2(g)=HgO(s) △H =-90.7 kJ·mol-1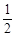 O2(g)=ZnO(s) 减去Hg(l)+
O2(g)=ZnO(s) 减去Hg(l)+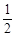 O2(g)=HgO(s)得到,所以Zn(s)+HgO(s)=ZnO(s)+Hg(l)的焓变为-351.1kJ·mol-1-(-90.7 kJ·mol-1)=-260.4 kJ·mol-1,故本题的答案选择A。
O2(g)=HgO(s)得到,所以Zn(s)+HgO(s)=ZnO(s)+Hg(l)的焓变为-351.1kJ·mol-1-(-90.7 kJ·mol-1)=-260.4 kJ·mol-1,故本题的答案选择A。