NOx是汽车尾气中的主要污染物之一。
(1) NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:_ .
(2)汽车发动机工作时会引发N2和02反应,其能量变化示意图如下:
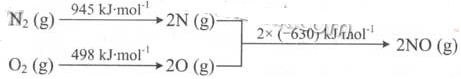
①写出该反应的热化学方程式: _ .
②随温度升高,该反应化学平衡常数的变化趋势是_ .。
(3)在汽车尾气系统中装置催化转化器,可有效降低NOX的排放。
①当尾气中空气不足时,NOX在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:_ .
② 当尾气中空气过量时,催化转化器中的金属氧化物吸收NOX生成盐。其吸收能力顺序如下:12MgO <2oCaO <38SrO<56BaO.原因是 .
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
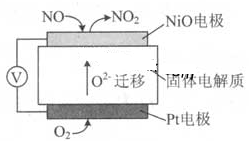
①Pt电极上发生的是 反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式: .
(1)3NO2+H2O=2HNO3+NO
(2)①N2(g)+O2(g) 2NO(g);ΔH=+183kJ/mol.②K值增大。
2NO(g);ΔH=+183kJ/mol.②K值增大。
(3)①2NO+2CO= N2+2CO.②Mg、Ca、Sr、Ba为同一主族元素,从上到下,原子半径逐渐增大元素的金属性逐渐增强,金属氧化物对NOX的吸收能力逐渐增强,元素的金属性逐渐增强,金属氧化物对NOX的吸收能力逐渐增强。
(4)①还原。②NO-2e-+O2-=NO2。
由NO2制备硝酸3NO2+H2O===2HNO3+NO;根据题给能量关系可得到热化学反应方程式N2(g)+O2(g) 2NO(g) ΔH="+183kJ/mol" ,该反应为吸热反应,升高温度,平衡向右移动,K值增大;一氧化氮与一氧化碳的反应生成氮气2NO+2CO= N2+2CO;Mg、Ca、Sr、Ba为同一主族元素,从上到下,原子半径逐渐增大元素的金属性逐渐增强,金属氧化物对NOX的吸收能力逐渐增强;电化学反应Pt电极为正极发生还原反应,O2+4e-=2O2-,NiO电极为负极发生氧化反应NO-2e-+O2-=NO2。
2NO(g) ΔH="+183kJ/mol" ,该反应为吸热反应,升高温度,平衡向右移动,K值增大;一氧化氮与一氧化碳的反应生成氮气2NO+2CO= N2+2CO;Mg、Ca、Sr、Ba为同一主族元素,从上到下,原子半径逐渐增大元素的金属性逐渐增强,金属氧化物对NOX的吸收能力逐渐增强;电化学反应Pt电极为正极发生还原反应,O2+4e-=2O2-,NiO电极为负极发生氧化反应NO-2e-+O2-=NO2。
(1)NOx能形成酸雨,NO2转化为HNO3的化学方程式为3NO2+H2O=2HNO3+NO.
(2)①盖斯定律可得,该反应的热化学方程式为N2(g)+O2(g) 2NO(g);ΔH=+183kJ/mol.
2NO(g);ΔH=+183kJ/mol.
②该反应为吸热反应,随温度升高,该反应化学平衡常数K值增大。
(3)在汽车尾气系统中装置催化转化器,可有效降低NOX的排放。
①NO被CO还原的化学方程式为2NO+2CO= N2+2CO.
②Mg、Ca、Sr、Ba为同一主族元素,从上到下,原子半径逐渐增大元素的金属性逐渐增强,金属氧化物对NOX的吸收能力逐渐增强,元素的金属性逐渐增强,金属氧化物对NOX的吸收能力逐渐增强。
(4)①Pt电极上发生的是还原反应。②NiO电极的电极反应式为NO-2e-+O2-=NO2。
【考点定位】本题以氮的氧化物为载体考查物质性质、热化学反应方程式、元素周期律以及元素周期表、电化学等相关知识。
