一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
2CO(g)+SO2(g)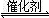 2CO2(g)+S(l) △H
2CO2(g)+S(l) △H
(1)已知2CO(g)+O2(g)= 2CO2(g) △H1=—566kJ•mol—1
S(l) +O2(g)= SO2(g) △H2=—296kJ•mol—1
则反应热ΔH= kJ•mol-1。
(2)其他条件相同、催化剂不同时,SO2的转化率随反应温度的变化如图a。260℃时 (填Fe2O3、NiO或Cr2O3)作催化剂反应速率最快。Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑价格因素,选择Fe2O3的主要优点是 。
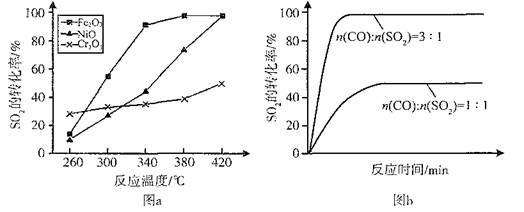
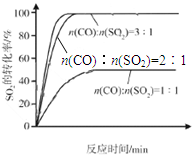
(3)科研小组在380℃、Fe2O3作催化剂时,研究了不同投料比[n(CO)∶n(SO2)]对SO2转化率的影响,结果如图b。请在答题卡坐标图中画出n(CO)∶n(SO2)="2∶1" 时,SO2转化率的预期变化曲线。
(4)工业上还可用Na2SO3溶液吸收烟气中的SO2:Na2SO3+SO2+H2O=2NaHSO3。某温度下用1.0mol•L-1 Na2SO3溶液吸收纯净的SO2,当溶液中c(SO32-)降至0.2mol•L-1时,吸收能力显著下降,应更换吸收剂。
①此时溶液中c(HSO3-)约为______mol•L-1;
②此时溶液pH=______。(已知该温度下SO32—+H+ HSO3—的平衡常数K="8.0" × 106 L•mol-1,计算时SO2、H2SO3的浓度忽略不计)
HSO3—的平衡常数K="8.0" × 106 L•mol-1,计算时SO2、H2SO3的浓度忽略不计)
(16分)
(1)—270 (3分)
(2)Cr2O3 (3分) Fe2O3作催化剂时,在相对较低温度可获得较高SO2的转化率,从而节约大量能源(3分)
(3)见下图 (3分)
(4)①1.6 (2分) ②6 (2分)
题目分析:(1)观察热化学方程式之间的关系,发现已知第1个热化学方程式减去第2个热化学方程式时,能够约去O2(g)得到2CO(g)+SO2(g)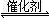 2CO2(g)+S(l),根据盖斯定律,该反应热ΔH=△H1—△H2=—270kJ•mol-1;(2)读图a可知,260℃时平衡转化率:Cr2O3> Fe2O3>NiO,由此推断Cr2O3作催化剂时反应速率最快;读图可知,Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,当SO2的转化率相同时,反应温度:Fe2O3<NiO,所以Fe2O3作催化剂时的主要优点是在相对较低温度可获得较高SO2的转化率,从而节约大量能源;(3)读图b可知,其他条件相同时,增大n(CO)∶n(SO2)的比值,就是增大CO或反应物浓度,既能增大反应速率,缩短达到平衡的时间,还使平衡向正反应反应方向移动,使SO2的转化率增大,由于图a中380℃时SO2的转化率最高,所以n(CO)∶n(SO2)的比值为2∶1变为3∶1时,SO2的平衡转化率基本上完全相同,只是达到平衡的时间缩短,由此可以在图b中画出有关温度对反应速率和平衡移动的影响图像;(4)依题意,Na2SO3、NaHSO3都是强电解质,可以推断反应物和生成物的起始浓度、变化浓度、更换试剂时浓度,则:
2CO2(g)+S(l),根据盖斯定律,该反应热ΔH=△H1—△H2=—270kJ•mol-1;(2)读图a可知,260℃时平衡转化率:Cr2O3> Fe2O3>NiO,由此推断Cr2O3作催化剂时反应速率最快;读图可知,Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,当SO2的转化率相同时,反应温度:Fe2O3<NiO,所以Fe2O3作催化剂时的主要优点是在相对较低温度可获得较高SO2的转化率,从而节约大量能源;(3)读图b可知,其他条件相同时,增大n(CO)∶n(SO2)的比值,就是增大CO或反应物浓度,既能增大反应速率,缩短达到平衡的时间,还使平衡向正反应反应方向移动,使SO2的转化率增大,由于图a中380℃时SO2的转化率最高,所以n(CO)∶n(SO2)的比值为2∶1变为3∶1时,SO2的平衡转化率基本上完全相同,只是达到平衡的时间缩短,由此可以在图b中画出有关温度对反应速率和平衡移动的影响图像;(4)依题意,Na2SO3、NaHSO3都是强电解质,可以推断反应物和生成物的起始浓度、变化浓度、更换试剂时浓度,则:
SO32—+SO2+H2O=2HSO3—
起始浓度(mol/L) 1.0 0
变化浓度(mol/L) 0.8 1.6
更换试剂时浓度(mol/L) 0.2 1.6
则更换试剂时,c(HSO3—)=1.6mol/L
由于SO32—+H+ HSO3—的平衡常数K= c(HSO3—)/[ c(SO32—)• c(H+)],则c(H+)= c(HSO3—)/[ c(SO32—)•K)],由于c(HSO3—)=1.6mol/L,c(SO32—)=0.2mol/L,该温度下K="8.0" × 106 L•mol-1,则c(H+)=1.6/(0.2×8.0 × 106) mol/L=10—6 mol/L;由于溶液的pH="—lg" c(H+)=—(—6)=6。
HSO3—的平衡常数K= c(HSO3—)/[ c(SO32—)• c(H+)],则c(H+)= c(HSO3—)/[ c(SO32—)•K)],由于c(HSO3—)=1.6mol/L,c(SO32—)=0.2mol/L,该温度下K="8.0" × 106 L•mol-1,则c(H+)=1.6/(0.2×8.0 × 106) mol/L=10—6 mol/L;由于溶液的pH="—lg" c(H+)=—(—6)=6。
