问题
计算题
使250 mL密度为1.1 g·cm-3、质量分数为 24.5%的硫酸跟铁屑充分反应。
(1)求此硫酸中H2SO4的物质的量浓度:
(2)求生成H2的体积(标准状况):
(3)将生成的硫酸亚铁配制成400 mL溶液,此溶液中硫酸亚铁的物质的量浓度是多少?
答案
(1)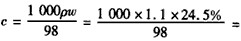 2.75 mol·L-1
2.75 mol·L-1
(2)n(H2SO4)=2.75 mol·L-1×0. 250 L≈ 0. 688 mol,
根据Fe+ H2SO4=FeSO4+H2↑
即知生成的氢气也为0. 688 mol,
在标准状况下的体积为0.688 mol×22.4L·mol-1=15.4L
(3)从(2)中可以求出硫酸亚铁也是0.688 mol,则

