工业上以NH3为原料经过一系列反应可以得到HNO3。
(1)工业上NH3的催化氧化反应方程式为 ;为了尽可能多地实现 向
向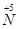 的转化,请你提出一条可行性建议 。
的转化,请你提出一条可行性建议 。
(2)将工业废气NO与CO混合,经三元催化剂转化器处理如下:2CO+2NO 2CO2+N2。
2CO2+N2。
已知:
CO(g)+ 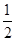 O2(g)=CO2(g) △H=-283.0kJ·mol-1
O2(g)=CO2(g) △H=-283.0kJ·mol-1
N2(g)+O2(g)=2NO(g) △H=+180.0kJ·mol-1
三元催化剂转化器中发生反应的热化学方程式为 ;
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度部分数据记录如下:
| 时间/s | 0 | 2 | 3 | 4 |
| c(NO)/mol·L-1 | 1.00×10-3 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
 C(CO)/mol·L-1 C(CO)/mol·L-1 |  |  2.70×10-3 2.70×10-3 |
①前2s内的平均反应速率v(CO)= ;
②在该温度下,反应的平衡常数K= ;
③假设在密闭容器中发生上述反应,达到平衡时下列措施能提高CO转化率的是
A.选用更有效的催化剂 B.恒容下充入Ar
C.适当降低反应体系的温度 D.缩小容器的体积
(1)4NH3+5O2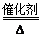 4NO+6H2O(2分) 在NO2中通入过量的空气,然后用水吸收生成硝酸(或其他合理答案)(1分)
4NO+6H2O(2分) 在NO2中通入过量的空气,然后用水吸收生成硝酸(或其他合理答案)(1分)
(2)2CO(g)+2NO(g)=2CO2(g)+N2(g) △H=-746.0kJ·mol-1(2分)
①4.25×10-4mol/(L·s) (2分) ②5000(2分) ③CD(2分,各1分)
题目分析:
本题是利用NH3制备HNO3一个工业上的应用。
(1)NH3的催化氧化反应方程式4NH3+5O2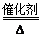 4NO+6H2O,
4NO+6H2O,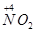 到
到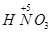 ,工业上是将NO2、过量O2通入H2O中,使得
,工业上是将NO2、过量O2通入H2O中,使得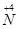 全被氧化又同时不产生污染性气体。
全被氧化又同时不产生污染性气体。
(2)根据盖斯定律将上式×2—下式即可得到2CO(g)+2NO(g)=2CO2(g)+N2(g) △H=-746.0kJ·mol-1
注意热化学方程式的书写规范
v(CO)= 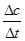 =4.25×10-4mol/(L·s) 注意单位书写
=4.25×10-4mol/(L·s) 注意单位书写
计算K的值,根据K的表达式:K=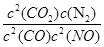 ,表达式中c都是平衡时的浓度。可以求出平衡时各物质的浓度分别为, c(NO)= 1.00×10-4mol/L,c(CO2)= 9.00×10-4 mol/L, C(CO)= 2.70×10-3 mol/L,c(N2)=4.50×10-4 mol/L,代入上式计算可得结果K=5000
,表达式中c都是平衡时的浓度。可以求出平衡时各物质的浓度分别为, c(NO)= 1.00×10-4mol/L,c(CO2)= 9.00×10-4 mol/L, C(CO)= 2.70×10-3 mol/L,c(N2)=4.50×10-4 mol/L,代入上式计算可得结果K=5000
CD都可使平衡正向移动,反应物转化率增大,A和B选项平衡不移动,转化率不变
