高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) △H= -28.5 kJ·(mol-1
2Fe(s)+3CO2(g) △H= -28.5 kJ·(mol-1
(1)已知:C(石墨)+CO2(g) 2CO(g) △H=" +" 172.5 kJ·mol-1
2CO(g) △H=" +" 172.5 kJ·mol-1
则反应:Fe2O3(S) +3C(石墨) 2Fe(s)+3CO(g) △H= kJ·mol-1
2Fe(s)+3CO(g) △H= kJ·mol-1
(2)冶炼铁反应 Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) △H=-28.5 kJ·mol-1的平衡常数表达式K= ,温度降低后,K值 .(填“增大”、“不变”或“减小”)。
2Fe(s)+3CO2(g) △H=-28.5 kJ·mol-1的平衡常数表达式K= ,温度降低后,K值 .(填“增大”、“不变”或“减小”)。
(3)在ToC时,该反应的平衡常数K=27,在1L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
| Fe2 O3 | CO | Fe | CO2 | |
| 甲容器 | 1.0 mol | 1.0 mol | 1.0 mol | 1.0 mol |
| 乙容器 | 1.0 mol | 2.0 mol | 1.0 mol | 1.0 mol |
①甲容器中CO的平衡转化率为
②下列说法正确的是 (填字母)。
a.乙容器中CO的平衡转化率小于甲容器
b.甲、乙容器中,CO2的平衡浓度之比为2:3
c.当容器内气体压强保持不变时,标志反应达到平衡状态
d.当容器中气体密度保持不变时,标志反应达到平衡状态
(4)钢铁工业是国家工业的基础,请回答钢铁腐蚀与防护过程中的有关问题。
①下列哪个装置可防止铁棒被腐蚀 (填编号)。
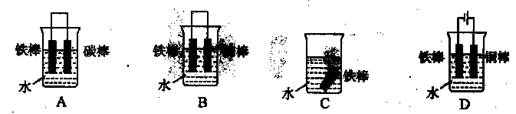
②在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图:A电极对应的金属是 (写元素名称),B电极的电极反应式是 。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因 。
(1)(2分)489
(2)(2分)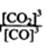 (1分);增大(1分)
(1分);增大(1分)
(3)75%(1分);b,d(2分)
(4)(7分)BD(2分);铜(1分);Cu2++2e‾="Cu" (2分)
锌、铁、铜金属活泼性依次减弱。镀层破损后在潮湿空气中形成原电池,镀锌铁铁为正极受到保护,而镀铜铁铁做负极更容易被腐蚀。(2分)
题目分析:(1)根据盖斯定律,要求反应的∆H与已知两个反应∆H的关系为:∆H = ∆H1 +3∆H2,代入数据可得结果。
(2)Fe2O3、Fe为固体,所以平衡常数表达式只含气体CO、CO2;该反应正反应放热,所以降低温度,化学平衡正向移动,平衡常数增大。
(3)①设转化的CO浓度为x,按照三段式带入数据:
Fe2O3(s)+3CO(g) 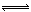 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
初始浓度: 1.0 1.0
转化浓度: x x
平衡浓度: 1.0-x 1.0+ x
带入平衡常数表达式:(1.0+x)3÷(1.0-x)3="27" 得x=0.5,
CO的转化率为:0.5÷1.0×100%=50%
②按照①的计算方法可求出乙容器中CO转化率为62.5%,故a项错误;甲容器CO2平衡浓度为1.5mol•L‾1, 乙容器CO2平衡浓度为2.25mol•L‾1,可得浓度之比为2:3,b项正确;本反应气体系数不变,所以压强保持不变,不能说明反应达到平衡,c项错误;当容器中气体密度保持不变时,说明气体质量不再变化,反应达到平衡,d项正确。
(4)B中铁为原电池的正极,D中铁为电解池的阴极,可防止铁棒被腐蚀;铜为镀层金属,为阳极材料,阴极为Cu2+得电子,镀层破损后,形成原电池,若铁为正极可防止腐蚀,若铁为负极则加快腐蚀速度。
