氮是地球上含量丰富的一种元素,氮元素的单质和化合物在工农业生产、生活中有重要用途。
(1)根据右下能量变化示意图:

写出CO和NO2反应生成NO和CO2的热化学方程式
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)  2NH3 (g) ΔH<0,
2NH3 (g) ΔH<0,
其平衡常数K与温度T的关系如下表,试判断K1 K2(填“>”、“=”或“<”)
| T /K | 298 | 398 |
| 平衡常数K | K1 | K2 |
(3)下列各项能说明该反应达到平衡状态的是 (填字母序号)
a. v(H2)正="3" v(N2)逆
b. 容器内压强保持不变
c. 容器中混合气体的密度保持不变
d.: N2、H2、NH3的浓度之比为1:3:2
(4)氨气极易溶于水,常用下图实验来验证,在标准状况下,烧瓶中的氨水使酚酞变红。
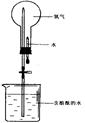
请回答:
①用化学用语说明所得氨水能使酚酞变红的原因 。
②250C时,将一定量的氨水与盐酸混合后pH=7,测该混合溶液中c(Cl-)与c(NH4+)关系为 (填字母序号)
a.c(Cl-)﹥c(NH4+) b.c(Cl-)﹦c(NH4+)
c. c(Cl-)﹤c(NH4+) d.无法判断
(8分)
(1)CO(g) +NO2 (g) =CO2(g)+NO (g) ΔH=-234kJ/mol (2分)
(2)> (1分)
(3)a b (2分)
(4)①NH3·H2O  NH4++OH- (其他合理答案也给分) (2分)
NH4++OH- (其他合理答案也给分) (2分)
② b (1分)
题目分析:(1)反应物断化学键吸收的能量-生成物形成化学键放出的能量=反应的焓变,所以△H=134KJ·mol-1-368KJ·mol-1=-234kJ·mol-1;CO和NO2反应生成NO和CO2的热化学方程式为:CO(g)+NO2(g)═CO2(g)+NO (g)△H=-234kJ·mol-1,
答案为:CO(g)+NO2(g)═CO2(g)+NO (g)△H=-234kJ·mol-1;
(2)N2(g)+3H2(g) 2NH3(g)△H<0,反应是放热反应,温度升高平衡逆向进行,平衡常数减小,所以K1>K2,故答案为:>;
2NH3(g)△H<0,反应是放热反应,温度升高平衡逆向进行,平衡常数减小,所以K1>K2,故答案为:>;
(3)a.依据正反应速率之比等于化学方程系数之比,V正(H2)=3V正(N2),依据v正(H2)=3v逆(N2)可知V正(N2)=v逆(N2),说明反应达到平衡,a正确;
b.反应前后气体体积分数变化,容器内压强保持不变证明反应达到平衡,b正确;
c.反应过程中气体质量和混合气体体积不变容器中混合气体的密度保持不变,不能证明反应达到化学平衡,c错误;
d.N2、H2、NH3的浓度之比为1:3:2只能说明反应了之比等于系数之比,不能证明反应达到平衡,d错误;
答案为:ab;
(4)①用化学用语说明所得氨水能使酚酞变红的原因,可以利用电离平衡说明,电离方程式为:NH3·H2O NH4++OH-,故答案为:NH3·H2O
NH4++OH-,故答案为:NH3·H2O NH4++OH-;
NH4++OH-;
②25℃时,依据溶液中存在的电荷守恒为c(H+)+c(NH4+)=c(OH-)+c(Cl-),将一定量的氨水与盐酸混合后pH=7,c(H+)=c(OH-),测该混合溶液中c(Cl-)与c(NH4+)关系相等,答案为:b.
考点 :反应热和焓变;化学平衡常数的含义;化学平衡状态的判断.
