电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
(1)已知25℃时,①HF(aq)+OH—(aq)=F—(aq)+H2O(l) ΔH=-67.7kJ/mol,
②H+(aq)+OH—(aq)=H2O(l) ΔH=-57.3kJ/mol,
氢氟酸的电离方程式及热效应可表示为________________________。
(2)将浓度为0.1 mol/LHF溶液加水稀释一倍(假设温度不变),下列各量增大的是____。
A.c(H+) B.c(H+)·c(OH—) C.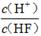 D.
D.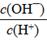
(3)25℃时,在20mL0.1mol/L氢氟酸中加入VmL0.1mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_____。
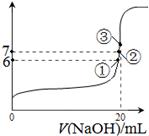
A.pH=3的HF溶液和pH=11的NaF溶液中, 由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F—)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F—)=c(Na+)
D.③点时V=20mL,此时溶液中c(F—)< c(Na+)=0.1mol/L
(4)物质的量浓度均为0.1mol/L的下列四种溶液: ① Na2CO3溶液 ② NaHCO3溶液③ NaF溶液 ④NaClO溶液。依据数据判断pH由大到小的顺序是______________。
(5)Na2CO3溶液显碱性是因为CO32—水解的缘故,请设计简单的实验事实证明之
___________________________________________________________。
(6)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H—O—F。HFO与水反应得到HF和化合物A,每生成1molHF转移 mol电子。
(1)HF(aq)  H+(aq) +F—(aq) △H=-10.4KJ·mol—1(不写可逆号扣1分)(2)CD
H+(aq) +F—(aq) △H=-10.4KJ·mol—1(不写可逆号扣1分)(2)CD
(3)BC (4)①④②③(或①>④>②>③,用物质名称表示也对)(5)在碳酸钠溶液中滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去或变浅。(6)1
题目分析:(1)利用盖斯定律将①-②可得,HF(aq)⇌F-(aq)+H+(aq)△H="-10.4" kJ•mol-1;(2)将浓度为0.1 mol/LHF溶液加水稀释一倍,c(H+)减小,根据水的离子积常数,c(OH—)增大,D选项正确。(3)A.酸碱抑制水的电离,盐促进水的电离,A选项错;B.根据电荷守恒,c(Na+)+c(H+)=c(F—)+c(OH—)此时溶液中, c(F—)-c(Na+)=c(H+)-c(OH—)=10-6-10-9=9.9×10-7mol/L ;C.根据电荷守恒和溶液呈中性,不难得到,溶液中的c(F—)=c(Na+);D.③点时V=20mL,此时酸碱溶液恰好完全反应,是氟化钠盐溶液,氟离子水解,溶液中c(F—)< c(Na+)=0.05mol/L。(4)酸越弱,所对应的盐溶液碱性越强;酸性:HF>H2CO3>HClO>HCO3- ,则所对应盐的碱性:Na2CO3溶液>NaClO溶液> NaHCO3溶液>NaF溶液 ;(5)在碳酸钠溶液中滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去或变浅。(6)HFO的原子连接顺序为H-O-F(八隅律,最外电子均为8),H-O中电子偏向O,O呈-1,O-F电子偏向F(F电负性大于O),O呈+1,综合O的化合价为0,F的化合价-1。
