铁元素是重要的金属元素,单质铁在工业和生活中使用得最为广泛。铁还有很多重要的化合物及其化学反应。如铁与水反应:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) △H
(1)上述反应的平衡常数表达式K=_______。
(2) 已知:①3Fe(s)+2O2(g)=Fe3O4(s) △H1=-1118.4kJ/mol
②2H2(g)+O2(g)=2H2O(g) △H2=-483.8kJ/mol
③2H2(g)+O2(g)=2H2O(l) △H3=-571.8kJ/mol
则△H=_______。
(3)在t0C时,该反应的平衡常数K=16,在2L恒温恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
①甲容器中H2O的平衡转化率为_______ (结果保留一位小数)。
②下列说法正确的是_______ (填编号)
A.若容器压强恒定,则反应达到平衡状态
B.若容器内气体密度恒定,则反应达到平衡状态
C.甲容器中H2O的平衡转化率大于乙容器中H2O的平衡转化率
D.增加Fe3O4就能提高H2O的转化率
(4)若将(3)中装置改为恒容绝热(不与外界交换能量)装置,按下表充入起始物质,起始时与平衡后的各物质的量见表:
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
若在达平衡后的装置中继续加入A、B、C三种状况下的各物质,见表:
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1 | 4 |
| C/mol | m | n | p | q |
当上述可逆反应再一次达到平衡状态后,上述各装置中H2的百分含量按由大到小的顺序排列的关系是
________(用A、B、C表示)。
(5)已知Fe(OH)3的Ksp=2.79×10-39,而FeCl3溶液总是显示较强的酸性,若某FeCl3溶液的pH为3,则该溶液中c(Fe3+)=________mol • L-1 (结果保留3位有效数字)
(每空2分,最后两空每空3分,共计14分)(1)K=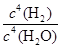 (2)-150.8kJ/mol
(2)-150.8kJ/mol
(3)①33.3% ②BC (4)B>C>A (5)2.79×10-6
题目分析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据该反应的化学方程式可知,平衡常数表达式K=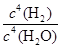 。
。
(2)根据盖斯定律可知,①-②×2即得到反应3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g),所以该反应的反应热△H=-1118.4kJ/mol+483.8kJ/mol×2=-150.8kJ/mol。
(3)① 3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g)
起始浓度(mol/L) 0.5 0.5
转化浓度(mol/L) x x
平衡浓度(mol/L) 0.5-x 0.5+x
则根据平衡常数K=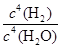 可知
可知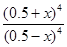 =16
=16
解得x=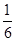 ,所以水蒸气的转化率=
,所以水蒸气的转化率=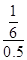 ×100%=33.3%
×100%=33.3%
②A、反应前后体积不变,压强始终不变,所以若容器压强恒定,则反应不一定达到平衡状态,A不正确;B、密度是混合气的质量和容器容积的比值,在反应过程中容器容积不变,氮气体的质量是变化的,所以若容器内气体密度恒定,则反应达到平衡状态,B正确;C、乙容器相当于是在甲容器的基础上增加水蒸气的浓度,平衡向正反应方向移动,但水蒸气的转化率降低,即甲容器中H2O的平衡转化率大于乙容器中H2O的平衡转化率,C正确;D、四氧化三铁是固体,所以增加Fe3O4不能提高H2O的转化率,D不正确,答案选BC。
(4)A相当于是在原平衡的基础上增大压强平衡不移动,但反应放热多。由于是绝热容器,温度升高,使平衡向逆反应方向移动,氢气含量降低;B也相当于是在原平衡的基础上增大压强平衡不移动,但反应吸热。由于是绝热容器,温度降低,使平衡向正反应方向移动,氢气含量增大;C相当于是等效平衡,氢气含量不变,所以各装置中H2的百分含量按由大到小的顺序排列的关系是B>C>A。
(5)FeCl3溶液的pH为3,则溶液中c(OH-)=10-11mol/L,所以Fe(OH)3的Ksp=2.79×10-39可知,溶液中c(Fe3+)=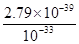 =2.79×10-6mol/L。
=2.79×10-6mol/L。
