氮及其化合物在工农业生产、生活中有者重要作用。请回答下列问题:
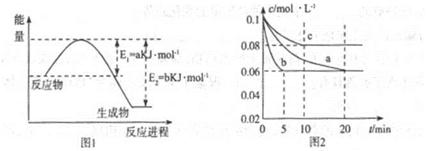
(1)图1是1molNO2和1molCO反应生成CO2和NO过程中能星变化示意图(a、b均大于0,)且知:2CO(g)+2NO(g)=N2(g)+2CO2(g)△H=-ckJ·mol-1(c>0)
请写出CO将NO2还原至N2时的热化学方程式____________;
(2)图2是实验室在三个不同条件的密闭容器中合成氨时,N2的浓度随时间的变化曲线(以a、b、c表示)。已知三个条件下起始加入浓度均为:c(N2)=0.1mol·L-1,c(H2)=0.3mol·L-1;合成氨的反应:N2(g)+3H2(g) 2NH3(g)△H<0
2NH3(g)△H<0
①计算在a达平衡时H2的转化率为______;
②由图2可知,b、c各有一个条件与a不同,则c的条件改变可能是______;
试写出判断b与a条件不同的理由____________;
(3)利用图2中c条件下合成氨(容积固定)。已知化学平衡常数K与温度(T)的关系如下表:

①试确定K1的相对大小,K1______4.1x106(填写“>”“-”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的 是______(填序号字母)。
A.容器内NH3的浓度保持不变 B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(4)①NH4Cl溶液呈酸性的原因是(用离子反应方程式表示 )______。
②250C时,将pH=x氨水与pH=y的疏酸(且x+y=14,x>11)等体积混合后,所得溶液中各种离子的浓度关系正确的是
A.[SO42-]>[NH4+]>[H+]>[OH-]
B.[NH4+]>[SO42-]>[OH-]>[H+]
C.[NH4+]+[H+]>[OH-]+[SO42-]
D.[NH4+]>[SO42-]>[H+]>[OH-]
(12分)
(1)4CO(g)+2NO2(g)=4CO2(g)+N2(g)△H=-(2b+c-2a)kJ·mol(2分)
或4CO(g)+2NO2(g)=4CO2(g)+N2(g)△H=(2a-2b-c)kJ·mol等
(2)①40%(2分)
②升高温度(1分);因为加入催化剂能缩短达到平衡的时间,但化学平衡不移动,所以b、a两条件下达到平衡是N2的浓度相同(或其他合理答案)(2分)。
(3)<(1分);AC(2分);
(4)①NH+4+H2O=NH3·H2O+H+(2分)
②BC(2分)
题目分析:。
(1)根据题干信息可以得到:①式NO2(g)+CO(g)=CO2(g)+NO(g)△H=-(b-a)kJ·mol,结合②式:2CO(g)+2NO(g)=N2(g)+2CO2(g)△H=-ckJ·mol-1(c>0),由①×2+②得CO将NO2还原至N2时的热化学方程式:4CO(g)+2NO2(g)=4CO2(g)+N2(g)△H=-(2b+c-2a)kJ·mol
(2)①平衡时氮气的浓度为0.06mol/L,转化的量为0.04mol/L,根据计量数之比H2转化的量为0.12mol/L,H2的转化率为0.12mol/L÷0.30mol/L×100%=40%;②升高温度合成氨的反应:N2(g)+3H2(g) 2NH3(g)△H<0为放热反应,氮气的转化率下降,缩短了到达平衡的时间,有可能。因为加入催化剂能缩短达到平衡的时间,但化学平衡不移动,所以b、a两条件下达到平衡使N2的浓度相同。
2NH3(g)△H<0为放热反应,氮气的转化率下降,缩短了到达平衡的时间,有可能。因为加入催化剂能缩短达到平衡的时间,但化学平衡不移动,所以b、a两条件下达到平衡使N2的浓度相同。
(3)①合成氨的反应:N2(g)+3H2(g) 2NH3(g)△H<0为放热反应,升高温度,平衡逆向移动,K会减小;②平衡时,各物质的量不变,所以A.容器内NH3的浓度保持不变,正确。C.容器内压强保持不变,正确。B.3v(N2)(正)=v(H2)(逆),错误。D.由于是恒容容器,总质量、总体积均不变,混合气体的密度保持不变,错误。
2NH3(g)△H<0为放热反应,升高温度,平衡逆向移动,K会减小;②平衡时,各物质的量不变,所以A.容器内NH3的浓度保持不变,正确。C.容器内压强保持不变,正确。B.3v(N2)(正)=v(H2)(逆),错误。D.由于是恒容容器,总质量、总体积均不变,混合气体的密度保持不变,错误。
(4)①NH4Cl的水解:NH4++H2O=NH3·H2O+H+;②,由x+y=14,氨水少量电离的OH-能与硫酸完全电离出的H+,说明氨水要远多于硫酸,等体积混合后溶液一定呈碱性[H+]<[OH-],结合电荷守恒式:
[NH4+]+[H+]=[OH-]+2[SO42-],可知BC正确。
