研究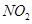 、
、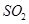 、CO等大气污染气体的测量及处理具有重要意义。
、CO等大气污染气体的测量及处理具有重要意义。
(1)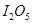 可使
可使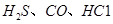 等氧化,常用于定量测定CO的含量。已知:
等氧化,常用于定量测定CO的含量。已知:

写出CO(g)与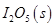 反应生成
反应生成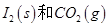 的热化学方程式:________________。
的热化学方程式:________________。
(2)CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,K+移向_______极(填“正”或“负”),正极反应方程式为:___________________。
(3)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷
酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料。
①该复合肥料可能的化学式为___________(写出一种即可)。
②若氨水与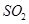 恰好完全反应生成正盐,则此时溶液呈________性(填“酸”或“碱”)。
恰好完全反应生成正盐,则此时溶液呈________性(填“酸”或“碱”)。
常温下弱电解质的电离平衡常数如下:氨水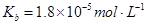
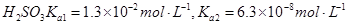
③向②中溶液中通入________气体可使溶液呈中性。(填“SO2”或NH3”)
此时溶液中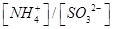 ________2(填“>”“<”或“=”)
________2(填“>”“<”或“=”)
(4)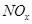 可用强碱溶液吸产生硝酸盐。在酸性条件下,FeSO4溶液能将
可用强碱溶液吸产生硝酸盐。在酸性条件下,FeSO4溶液能将 还原为NO,写出该过程中产生NO反应的离子方程式___________________________________。
还原为NO,写出该过程中产生NO反应的离子方程式___________________________________。
(每空2分)
(1)5CO(g) + I2O5(s) = 5CO2 + I2(s) ∆H= -1377.22kJ•mol‾1
(2)正,O2 + 2H2O +4e‾ = 4OH‾
(3)① (NH4)3PO4或(NH4)2HPO4或NH4H2PO4
②碱 ③ SO2 >
(4)3Fe2+ + NO3‾ + 4H+ =3Fe3+ +NO↑+ 2H2O
题目分析:(1)先写出化学方程式,标明各物质的状态,然后根据盖斯定律求算∆H,
∆H= —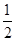 ∆H1 +
∆H1 + 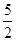 ∆H2,带入相关数据可得答案。
∆H2,带入相关数据可得答案。
(2)原电池电解质溶液中,阳离子移向正极;电解质为KOH溶液,所以正极反应为O2在H2O存在条件下得电子生成OH‾。
(3)①分析反应物,氨气、二氧化硫反应后再与磷酸反应,由磷酸的量不同可生成(NH4)3PO4或(NH4)2HPO4或NH4H2PO4。
②氨水与SO2恰好完全反应生成(NH4)2SO3,水解显碱性。
③因为②中溶液显碱性,所以通入SO2可中和OH‾,使溶液显中性;根据电荷守恒可知:[NH4+]+[H+]=[OH‾]+2[SO32‾]+[HSO3‾],溶液中性[H+]=[OH‾],得[NH4+]=2[SO32‾]+[HSO3‾],所以[NH4+]/[SO32‾]>2。
(4)根据信息找出反应物和生成物,配平可得离子方程式。

