近年来,以天然气等为原料合成甲醇的难题被一一攻克,极大地促进了甲醇化学的发展。
(1)与炭和水蒸气的反应相似,以天然气为原料也可以制得CO和H2,该反应的化学方程式为_________。
(2)合成甲醇的一种方法是以CO和H2为原料,其能量变化如图所示:

由图可知,合成甲醇的热化学方程式为________________________________________。
(3)以CO2为原料也可以合成甲醇,其反应原理为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
①在lL的密闭容器中,充入1molCO2和3molH2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时问变化如图所示:
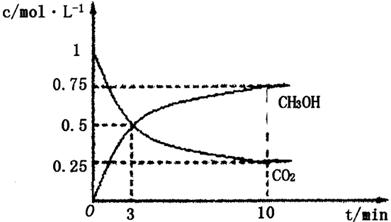
则下列说法正确的是_________________(填字母);
A.3min时反应达到平衡
B.0~10min时用H2表示的反应速率为0.225mol·-1·min-1
C.CO2的平衡转化率为25%
D.该温度时化学平衡常数为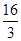 (mol/L)-2②在相同温度、相同容积的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
(mol/L)-2②在相同温度、相同容积的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 容器1 | 容器2 | 容器3 |
| 反应物投入量(始态) | 1molCO2、3molH2 | 0.5molCO2、1.5molH2 | 1molCH3OH、1molH2O |
| CH3OH的平衡浓度/mol•L-1 | c1 | c2 | c3 |
| 平衡时体系压强/Pa | p1 | p2 | p3 |
则下列各量的大小关系为c1___________c3,p2_________p3(填“大于”、“等于”或“小于”)。
(4)近年来,甲醇燃料电池技术获得了新的突破,如图所示为甲醇燃料电池的装置示意图。电池工作时,分别从b、c充入CH3OH、O2,回答下列问题:
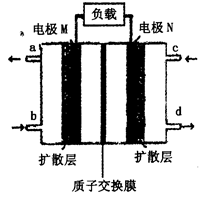
①从d处排出的物质是___________,溶液中的质子移向电极__________(填“M”或“N”);
②电极M上发生的电极反应式为__________________________。
(16分、每空2分)(1)CH4+H2O CO+3H2
CO+3H2
(2)CO(g)+2H2(g)=CH3OH(g) △H=(a-b)kJ/mol (3)①BD ②等于;小于
(4)①H2O N ②CH3OH+H2O-6e-=CO2↑+6H+
题目分析:(1)反应物是甲烷和水,生成物是一氧化碳和氢气,根据原子生活借助于观察法配平,反应条件是高温和催化剂,所以该反应的化学方程式是CH4+H2O CO+3H2。
CO+3H2。
(2)根据根据图像可知,反应物的总能量高于生成物的总能量,因此反应是放热反应,其反应热△H=(a-b)kJ/mol,所以其热化学反应方程式为CO(g)+2H2(g)=CH3OH(g) △H=(a-b)kJ/mol。
(3)①A、根据图像可知,3min后各物质的浓度还发生变化,所以3min时该反应未达到平衡,故A错误; B、根据图像可知,在0~10min内甲醇的浓度增加了0.75mol/L,所以根据反应的化学方程式可知,消耗氢气的浓度是0.75mol/L×3=2.25mol/L,因此0~10min时用H2表示的反应速率=2.25mol/L÷10min=0.225mol/(L·min),故B正确;C、根据图像可知CO2的平衡转化率= ×100%=75%,故C错误; D、根据图像和以上分析可知,平衡时c(CO2)=0.25mol/L,c(CH3OH)=c(H2O)=0.75mol/L,c(H2)=3c(CO2)=0.75mol/L,所以该温度下反应的化学平衡常数K=
×100%=75%,故C错误; D、根据图像和以上分析可知,平衡时c(CO2)=0.25mol/L,c(CH3OH)=c(H2O)=0.75mol/L,c(H2)=3c(CO2)=0.75mol/L,所以该温度下反应的化学平衡常数K= =
=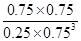 =
= (mol/L)-2,D正确,答案选BD。
(mol/L)-2,D正确,答案选BD。
②根据方程式并采用一边倒的方法可知,1molCH3OH、1molH2O完全转化为反应物就是1molCO2、3molH2,因此容器1和容器3是等效平衡,所以平衡时甲醇的浓度c1等于c3;容器2相当于在容器1的基础上减小压强,平衡向逆反应方向移动,则平衡时p2 小于p3。
(4)①原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。因此该燃料电池中,负极通入甲醇,正极通入氧气。c电极上充入氧气,即电极N是正极,氧气得电子和氢离子反应生成水,所以d出来的是水,原电池放电时,氢离子向正极N极移动。
②电极M是负极,通入的是甲醇,失去电子发生氧化反应,因此发生的电极反应式为CH3OH+H2O-6e-=CO2↑+6H+。
