(14分)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
CH4(g)+H2O(g) ===CO(g)+3H2(g) ΔH=+206.2 kJ/mol
CH4(g)+CO2(g) ===2CO(g)+2H2(g) ΔH=+247.4 kJ/mol
CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 。
(2)硫铁矿(FeS2)燃烧产生的SO2通过下列碘循环工艺过程既能制H2SO4,又能制H2。
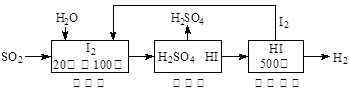
已知1g FeS2完全燃烧放出7.1 kJ热量,FeS2燃烧反应的热化学方程式为 。
该循环工艺过程的总反应方程式为 。
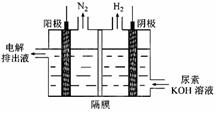
(3)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为 。
(4)用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:
NiO(OH)+MH Ni(OH)2+M
Ni(OH)2+M
①电池放电时,正极的电极反应式为 。
②充电完成时,Ni(OH)2全部转化为NiO(OH)。若继续充电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为 。
(5)Mg2Cu是一种储氢合金。350℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为 。
(14分)
(1)CH4(g)+2H2O(g) ===CO2(g) +4H2(g) △H=165.0 kJ/mol (2分)
(2)4FeS2(s)+11O2(g) === 2Fe2O3(s)+8SO2(g) △H=-3408 kJ/mol (2分)
2H2O+SO2===H2SO4+H2 (2分)
(3)CO(NH2)2+8OH--6e-===CO32-+N2↑+6H2O (2分)
(4)①NiO(OH)+H2O+e-===Ni(OH)2+OH-(2分)
②2H2O+O2+4e-===4OH- (2分)
(5)2Mg2Cu+3H2 MgCu2+3MgH2 (2分) B
MgCu2+3MgH2 (2分) B
题目分析:(1)已知:①CH4(g)+H2O(g)═CO(g)+3H2 (g)△H=-206.2kJ•mol-1②CH4(g)+CO2 (g)═2CO(g)+2H2 (g)△H=-247.4kJ•mol-1由盖斯定律,①×2-②得CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=-165.0 kJ•mol-1,故答案为:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=-165.0 kJ•mol-1;
(2)根据题目信息,已知1g FeS2完全燃烧放出7.1 kJ热量,求得4mol FeS2完全燃烧放出3408 kJ热量,故方程式为4FeS2(s)+11O2(g) === 2Fe2O3(s)+8SO2(g) △H=-3408 kJ/mol ;由反应物到最终产物,并根据原子,元素守恒可写为 2H2O+SO2===H2SO4+H2 ;
(3)由图可知,CO(NH2)2在阳极放电生成N2,C元素价态未变化,故还有碳酸钾生成与水生成,电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O,故答案为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O;
(4)①电池放电时,正极的电极要得到电子,反应式NiO(OH)+H2O+e-===Ni(OH)2+OH-(2分) ②据题意氧气要削耗掉,故反应2H2O+O2+4e-===4OH-
(5)令金属氢化物为RHx,金属R的相对分子质量为a,则X/(a+X)=0.077,即923x=77a,X为金属的化合价,讨论可得x=2,a=24,故该金属氢化物为MgH2,故反应方程式为2Mg2Cu+3H2==MgCu2+3MgH2,故答案为:2Mg2Cu+3H2=MgCu2+3MgH2.
