汽车尾气已成为重要的空气污染物。
(1)汽车内燃机工作时引起反应:N2(g)+O2(g)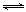 2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向5L密闭容器中充入8mol N2和9molO2,5min后达平衡时NO物质的量为6mol,计算该条件下的平衡常数(写出计算过程)。
2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向5L密闭容器中充入8mol N2和9molO2,5min后达平衡时NO物质的量为6mol,计算该条件下的平衡常数(写出计算过程)。
(2)H2或CO可以催化还原NO以达到消除污染的目的:
①已知:N2(g)+ O2(g) = 2NO(g) △H = +180.5kJ/mol
2H2(g)+ O2(g) = 2H2O(l) △H = -571.6kJ/mol
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式为 。
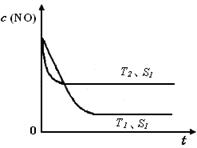
②当质量一定时,增大固体催化剂的表面积可提高化学反应速率。右图是反应:2NO(g) + 2CO(g) 2CO2(g)+ N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,据此判断该反应的△H 0 (填“>”、“<”或“无法确定”)。若催化剂的表面积S1>S2 ,在图中画出NO的浓度在T1、S2 条件下达到平衡过程中的变化曲线,并注明条件。
2CO2(g)+ N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,据此判断该反应的△H 0 (填“>”、“<”或“无法确定”)。若催化剂的表面积S1>S2 ,在图中画出NO的浓度在T1、S2 条件下达到平衡过程中的变化曲线,并注明条件。
(10分)(1) N2(g) + O2(g) 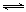 2NO(g)
2NO(g)
起始浓度(mol·L-1)1.6 1.8 0
转化浓度(mol·L-1)0.6 0.6 1.2 (2分)
平衡浓度(mol·L-1)1.0 1.2 1.2
平衡常数K=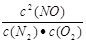 (1分)
(1分)
=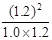 =1.2 (1分)
=1.2 (1分)
【①计算结果正确但三段式不完整或不写平衡常数表达式均扣1分;②用物质的量计算平衡常数即便结果正确也只能得过程2分。】
(2)①2H2(g)+ 2NO(g)= N2(g)+2H2O(l) △H = -752.1kJ/mol(2分)
【①不标或标错物质状态或△H计算错误不得分;②计量数和△H成比例增加或减少也得2分】
②< (2分);【填“小于”扣1分】
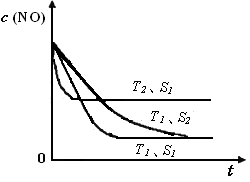 (2分)
(2分)
【①曲线画错不得分:注意起始点、变化趋势、拐点;②曲线正确但不标条件扣1分。】
题目分析:(1)(1) N2(g) + O2(g) 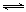 2NO(g)
2NO(g)
起始浓度(mol·L-1)1.6 1.8 0
转化浓度(mol·L-1)0.6 0.6 1.2
平衡浓度(mol·L-1)1.0 1.2 1.2
平衡常数K=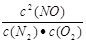 =
=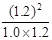 =1.2;(2)根据盖斯定律,已知的前一个热化学方程式减去后一个热化学方程式,可以得到:2H2(g) + 2NO(g)=N2(g) + 2H2O(l) △H = -752.1 kJ·mol-1;(3)读图,两条曲线先后达到平衡,说明T2>T1,即升高温度,平衡时c(NO)增大,由于升温平衡向吸热方向移动,c(NO)增大说明平衡向逆反应方向移动,则逆反应是吸热反应,所以正反应是放热反应,△H<0;画图要点:S1变为S2,即减小催化剂表面积,反应速率减小,单位时间内NO的变化浓度减小,则T1、S2的曲线位于T1、S1曲线的右边;催化剂不能使平衡移动,所以NO的平衡浓度与T1、S1曲线相同,只是达到平衡的时间比T1、S1曲线增大。
=1.2;(2)根据盖斯定律,已知的前一个热化学方程式减去后一个热化学方程式,可以得到:2H2(g) + 2NO(g)=N2(g) + 2H2O(l) △H = -752.1 kJ·mol-1;(3)读图,两条曲线先后达到平衡,说明T2>T1,即升高温度,平衡时c(NO)增大,由于升温平衡向吸热方向移动,c(NO)增大说明平衡向逆反应方向移动,则逆反应是吸热反应,所以正反应是放热反应,△H<0;画图要点:S1变为S2,即减小催化剂表面积,反应速率减小,单位时间内NO的变化浓度减小,则T1、S2的曲线位于T1、S1曲线的右边;催化剂不能使平衡移动,所以NO的平衡浓度与T1、S1曲线相同,只是达到平衡的时间比T1、S1曲线增大。
