(1)医疗上常用浓度为75%的某有机物水溶液作皮肤消毒液。该有机物的结构简式是 。
(2)一定条件下,0.1mol氨气与氧气反应生成两种无毒气体,放出31.67kJ热量。写出核反应的热化学方程式: 。
(3)现有固体X,可能含有Cu、SiO2、KNO3、NH4Cl中的一种或几种。为了探究其成分,某学习小组取该样品进行如下实验(部分产物已略去)。
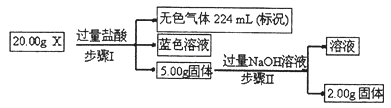
①步骤I中发生反应的离子方程式为 。
②20.00gX中Cu的质量分数为 。
③为进一步确定固体X的组成,常温下,学习小组另取固体X加水,充分搅拌后过滤,测得滤液的pH<7。他们判断一定有NH4Cl,理由是 。
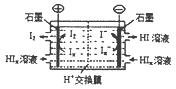
(4)工业上常用电渗析法生产HI,其模拟实验如图。写出阴极的电极反应式: 。
(15分)(1)CH3CH2OH(2分)
(2)4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=—1266.8kJ•mol—1(3分)
(3)①3Cu+8H++2NO3—=3Cu2++2NO↑+4H2O(3分)
②4.8%(3分)
③NH4Cl中NH4+发生水解反应,使溶液呈酸性(或写出正确的水解方程式)(2分)
(4)Ix+xe—=xI—(2分)
题目分析:(1)75%的乙醇溶液常用于医疗消毒,乙醇的结构简式为CH3CH2OH;(2)根据题意,1/10NH3(g)+3/40O2(g)=1/20N2(g)+3/20H2O(g) △H=—31.67kJ•mol—1,或者4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=—1266.8kJ•mol—1;(3)①步骤I中铜与硝酸钾在酸性条件下发生氧化还原反应,由电子、电荷、原子守恒可得反应式3Cu+8H++2NO3—=3Cu2++2NO↑+4H2O;②由V/Vm可知n(NO)=224×10—3L÷22.4L•mol—1=0.01mol,由反应式可知,n(Cu)=3/2n(NO)=0.015mol,由n•M可知,m(Cu)=0.015mol×64g/mol=0.96g,则X中Cu的质量分数为0.96g÷20.00g×100%=4.8%;③NH4Cl中NH4+发生水解反应,使溶液呈酸性,KNO3不能水解,其溶液呈中性,铜和二氧化硅难溶于水;(4)阴极发生还原反应,读图可知,阴极反应式为Ix+xe—=xI—,阴极产物与移向阴极的H+结合生成HI;阳极反应式为2Ix——2e—=xI2。
