氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用。
(1)一定温度下,在1L容积恒定的密闭容器中充入2 mol N2和8molH2并发生反应。10min达平衡,测得氨气的浓度为0.4 mol·L-1,此时氮气的转化率为________。若想提高氨气的产率,根据化学平衡移动原理,提出合理的建议______________(写出一条即可)。
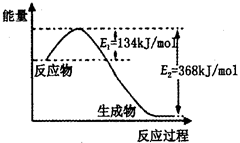
(2)如图是1mol NO2(g)和1mol CO(g)反应生成lmol CO2(g)和1 mol NO(g)过程中能量变化示意图,请写出该反应的热化学方程式_____________________。
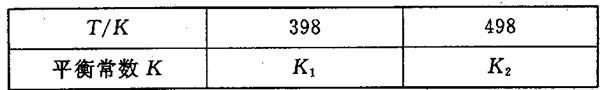
(3)在容积恒定的密闭容器中,进行如下反应:N2(g)+3H2(g)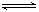 2NH3(g)△H<0,其平衡常数K与温度T的关系如下表:
2NH3(g)△H<0,其平衡常数K与温度T的关系如下表:
①该反应的平衡常数表达式:K=_____________;
②试判断K1__________K2(填写“>”“=”或“<”);
③NH3(g)燃烧的方程式为:4NH3(g)+7O2(g)=4NO2(g)+6H2O(l),已知:
①2H2(g)+O2(g)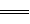 2H2O(l) △H=-483.6 kJ/mol
2H2O(l) △H=-483.6 kJ/mol
②N2(g)+2O2(g)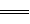 2NO2(g) △H=+67.8 kJ/mol
2NO2(g) △H=+67.8 kJ/mol
③N2(g)+3H2(g)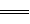 2NH3(g) △H=-92.0 kJ/mol
2NH3(g) △H=-92.0 kJ/mol
请计算NH3(g)的燃烧热________kJ/mol。
(1)10%;增大反应物的浓度、降温、增大压强等;
(2)NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234 kJ/mol;
(3)①K=c2(NH3)/ c(N2) c3(H2);②>;③282.8
题目分析:(1)根据题意知,平衡时氨气的物质的量为0.4mol,根据N2(g)+3H2(g)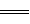 2NH3(g)知,转化的氮气的物质的量为0.2mol,氮气的转化率为10%;若想提高氨气的产率,根据化学平衡移动原理,提出合理的建议:增大反应物的浓度、降温、增大压强等;(2)由题给图像知,该反应的焓变△H=E1—E2=134KJ/mol—368KJ/mol=—234KJ/mol,热化学方程式为NO2(g)+CO(g)=CO2(g)+NO(g)△H=—234 kJ/mol,(3)①根据化学平衡常数的定义写出,K=c2(NH3)/ c(N2) c3(H2);②合成氨的反应为放热反应,升高温度,平衡逆向移动,平衡常数减小,所以K1>K2;③根据盖斯定律:①×3+②×2—③×2得,4NH3(g)+7O2(g)=4NO2(g)+6H2O(l),△H=—1131.2 kJ/mol,结合燃烧热的定义知,NH3(g)的燃烧热282.8kJ/mol。
2NH3(g)知,转化的氮气的物质的量为0.2mol,氮气的转化率为10%;若想提高氨气的产率,根据化学平衡移动原理,提出合理的建议:增大反应物的浓度、降温、增大压强等;(2)由题给图像知,该反应的焓变△H=E1—E2=134KJ/mol—368KJ/mol=—234KJ/mol,热化学方程式为NO2(g)+CO(g)=CO2(g)+NO(g)△H=—234 kJ/mol,(3)①根据化学平衡常数的定义写出,K=c2(NH3)/ c(N2) c3(H2);②合成氨的反应为放热反应,升高温度,平衡逆向移动,平衡常数减小,所以K1>K2;③根据盖斯定律:①×3+②×2—③×2得,4NH3(g)+7O2(g)=4NO2(g)+6H2O(l),△H=—1131.2 kJ/mol,结合燃烧热的定义知,NH3(g)的燃烧热282.8kJ/mol。
