水是生命之源,也是化学反应中的主角。请回答下列问题:
Ⅰ、氢气燃烧生成液态水热化学方程式是2H2(g)+O2(g)=2H2O(l) ΔH=-572kJ/mol。
(1)生成物能量总和(填“大于”、“小于”或“等于”)反应物能量总和。
(2)若2 mol氢气完全燃烧生成水蒸气,则放出的热量 572 kJ(填“>”、“<”或“=”)。
(3)氢气热值为 。
Ⅱ、氢气和氧气反应生成水,将化学能转化为电能,其构造如图所示:a、b两个电极均由多孔的碳块组成。

(1)a电极反应式是
(2)b电极反应式是
Ⅲ、如图表示一个电解池。X、Y都是惰性电极,电解液a是饱和食盐水,同时在两边各滴入几滴酚酞试液。
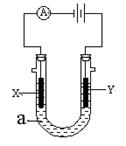
(1)X极上的电极反应式为 ,
在X极附近观察到的现象是 。
(2)Y极上的电极反应式为 ,
检验该电极反应产物的方法是 。
Ⅰ(1) 小于(2) <(3) 143 kJ/g
Ⅱ、(1) H2-2e- + 2OH-=2H2O(2)O2 + 4e- + 2H2O=4OH-
Ⅲ、(1) 2H+ + 2e-=H2↑ 或2H2O + 2e-=H2+2OH-↑;产生气泡,溶液变红
(2) 2Cl-- 2e-=Cl2↑;用湿润的淀粉碘化钾试纸检验,试纸变蓝(其它合理方法亦可)
题目分析:Ⅰ、(1)该反应正反应为放热反应,生成物的总能量小于反应物总能量。(2)气态水的能量高于液体水,故生成2mol气态水放出的热量小于572kJ。(3)值指1kg燃料完全燃烧放出的热量,由热化学方程式可知,1kg氢气燃烧放出的热量为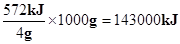 ,故氢气的热值为143kJ/g。
,故氢气的热值为143kJ/g。
Ⅱ、(1)a极通入H2,发生氧化反应,在碱性条件下生成水,电极反应式为:H2 + 2OH– – 2e–=2H2O。(2)b极通入O2,发生还原反应,生成OH–,电极反应式为:O2 + 2H2O + 4e–=4OH–。
Ⅲ、(1)X极连接电源的负极,为阴极,发生还原反应,H2O电离产生的H+在X极放电生成H2,同时生成OH–,电极反应式为:2H2O + 2e–=H2↑ + 2OH–,溶液呈碱性,故可观察到的现象为:产生气泡,溶液变红色。(2)Y极连接电源的正极,为阳极,发生氧化反应,Cl–在Y极放电生成Cl2,电极反应式为:2Cl--2e-=Cl2↑,用湿润的淀粉KI试纸检验,试纸变蓝。
