红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)
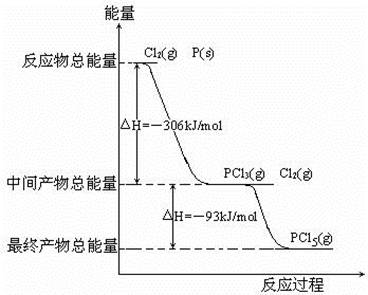
据图回答下列问题
(1)P和Cl2反应生成PCl3的热化学方程式 ;
(2)PCl5分解生成PCl3和Cl2的热化学方程式 ;
上述分解反是一个可逆反应,温度T1时,在密闭容器中加入0.8mol PCl5,反应达到平衡时还剩余0.6mol PCl5,其分解率α1等于 ;若反应温度由T1升高到T2,平衡时PCl5分解率α2,α2 α1(填“大于”,“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是 ;
(4)P和Cl2分两步反应生成1mol PCl5的△H3= ;P和Cl2一步反应生成1mol PCl5的△H4 △H3 (填“大于”、“小于”或“等于”),原因是 。
(1)2P(s)+3Cl2(g)=2PCl3(g) △H =-612kJ/mol(2分)
(2)PCl5(g)=PCl3(g)+Cl2(g) △H =+93kJ/mol(2分) 25%(2分) 大于(2分)
(3)因为PCl5分解反应是吸热反应,温度太高,不利于PCl5的生成(2分)
(4)-399kJ/mol (2分) 等于(1分),根据盖斯定律可知,如果一个化学反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的(2分)
题目分析:(1)首先写出化学方程式并注明状态,然后根据图中的△H表示生成1mol产物的数据,可求出∆H=2×-306kJ•mol‾1=-612kJ•mol‾1,进而写出热化学方程式。
(2)PCl5分解生成PCl3和Cl2为图中反应的逆反应,∆H为相反数,为+93kJ•mol‾1;加入0.8mol PCl5,反应达到平衡时还剩余0.6mol PCl5,说明反应了0.2molPCl5,则分解率α1=0.2mol÷0.8mol×100%=25%;因为PCl5分解为吸热反应,温度升高,PCl5的分解率增大,故α2大于α1。
(3)温度过高,会促进PCl5的分解,不利于生成PCl5。
(4)根据图示可求出P和Cl2分两步反应生成1mol PCl5的△H3= —306kJ•mol‾1—93kJ•mol‾1=-399kJ•mol‾1;根据盖斯定律,对于一个化学反应,无论是一步完成还是分几步完成,其反应焓变都是一样的,所以∆H3=∆H4。
