工业上生产金属钛的方法很多。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为:
FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
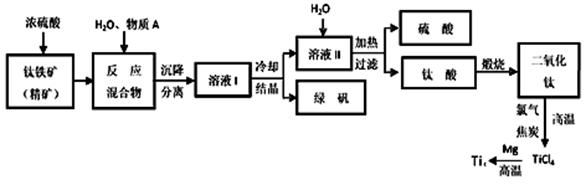
回答下列问题:
(1)钛铁矿和浓硫酸反应属于______________________ (选填“氧化还原反应”或“非氧化还原反应”)。
(2)上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是________,上述制备TiO2的过程中,所得到的副产物和可回收利用的物质分别是__________、___________。
(3)反应TiCl4+2Mg=2MgCl2+Ti在Ar气氛中进行的理由是_______________。
(4)由二氧化钛制取四氯化钛所涉及的反应有:
TiO2 (s)+ 2Cl2 (g) +2C(s) =TiCl4(g) + 2CO(g) ΔH1 = -72 kJ•mol-1
TiO2(s) + 2Cl2 (g) =TiCl4(g) + O2 (g) ΔH2 =+38.8kJ•mol-1
C(s)+CO2(g)=2CO(g) ΔH3 =+282.8kJ•mol-1
①反应C(s)+CO2(g)=2CO(g)在高温下能够自发进行的原因是______________________。
②反应C(s)+O2(g)=CO2 (g)的ΔH=_______________。
(5)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用下图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。①写出阳极所发生反应的电极反应式:________________________________。
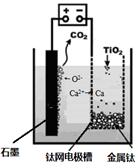
②在制备金属钛前后,CaO的总量不变,其原因是(请结合化学用语解释) 。
(1)非氧化还原反应 (2分) (2)Fe (2分) 绿矾 硫酸 (各1分)
(3)防止高温下Mg(Ti)与空气中的氧气(或CO2、N2)作用) (2分)
(4)① 该反应的△S>0(熵增)(2分) ②-393.6 kJ/mol (2分,单位1分)
(5)① 2O2- - 4e- = O2↑(同时写出C + O2 = CO2不扣分)
或 C + 2O2- - 4e- = CO2↑(2分)
②制备TiO2时,在电解槽发生如下反应:2CaO  2Ca + O2↑,
2Ca + O2↑,
2Ca + TiO2 Ti + 2CaO,由此可见,CaO的量不变。(4分)
Ti + 2CaO,由此可见,CaO的量不变。(4分)
题目分析:
(1)该反应中未发生化合价的变化。
(2)利用铁的还原性,防止亚铁被氧化 由流程图可知副产物有:绿矾和硫酸
(3)利用惰性气体隔绝空气,防止发生副反应。
(4)①根据ΔG=ΔH – TΔS < 0 能自发进行,则该反应的ΔS > 0。
(5)①熔融CaF2-CaO作电解质,该条件下能存在O2-
② 电解槽中发生反应:2CaO="2Ca" + O2↑, 2Ca + TiO2="Ti" + 2CaO,所以CaO的量不变。
