(1)已知:2NO2(g) N2O4(g);△H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
N2O4(g);△H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
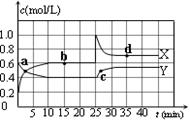
①a、b、c、d四个点中,表示化学反应处于平衡状态的点是 。
②前10 min内用NO2表示的化学反应速率v(NO2)= mol·L-1·min-1。反应在第一个平衡点的平衡常数K(1)= (可用分数表示)。反应在第二个平衡点的平衡常数K(2)与第一个平衡点的平衡常数K(1)的关系:K(2) K(1)(填“>”、“=”或“<”)。
③请在右图坐标中画出1 mol N2O4通入2L的密闭容器中反应发生过程中的能量变化示意图,并在虚线上分别标出反应物和生成物的化学式。
(2)右图中a、b、c、d分别代表氧族元素(ⅥA族):Te(碲)、Se(硒)、S、O氢化物的反应热的数据示意图。试回答下列问题:

①请你归纳:非金属元素氢化物的稳定性与形成氢化物的反应热△H的关系 。
②写出硒化氢发生分解反应的热化学反应方程式: 。
(1)①b,d ② 0.04(1分) 10/9 =(1分)
③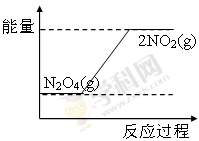 或
或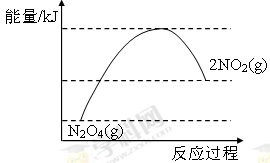
(2)①非金属元素氢化物越稳定,△H越小,反之亦然;②H2Se(g)=Se(s)+H2(g) △H=-81kJ/mol
题目分析:(1)①由图可知,10~25min及35min之后X、Y的物质的量不发生变化,则相应时间段内的点处于化学平衡状态,即b、d处于化学平衡状态,故答案为:b、d。
②根据化学计量数和图像的变化趋势可知,X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线。由图可知,前10min内,NO2的浓度变化量为(0.6-0.2)mol/L=0.4mol/L,所以υ(NO2)=0.4mol/L÷10min=0.04mol•L-1•min-1。根据图像可知,反应在第一个平衡点是NO2和N2O4的浓度分别是0.6mol/L和0.4mol/L,则该反应的平衡常数K(1)=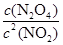 =
=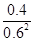 =
=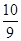 。在25min时NO2的浓度增大,N2O4浓度不变,这说明改变的条件一定不是温度,只能是增大生成物的浓度。平衡常数只与温度有关系,所以平衡常数不变,即K(2)=K(1)。
。在25min时NO2的浓度增大,N2O4浓度不变,这说明改变的条件一定不是温度,只能是增大生成物的浓度。平衡常数只与温度有关系,所以平衡常数不变,即K(2)=K(1)。
③NO2转化为N2O4的反应是放热反应,所以其能量变化示意图为 或
或 。
。
(2)①根据图像可知,Te(碲)、Se(硒)、S、O氢化物的反应热逐渐降低,而氢化物的稳定性逐渐升高,这说明非金属元素氢化物越稳定,△H越小,反之亦然;
②根据图像可知,硒化氢的反应热是+81kJ/mol,所以硒化氢发生分解反应是放热反应,则其热化学反应方程式H2Se(g)=Se(s)+H2(g) △H=-81kJ/mol。
