依据叙述,写出下列反应的热化学方程式。
(1)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有4NA个电子转移时,放出450 kJ的热量。其热化学方程式为______________________。
(2)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、395 kJ、940 kJ,则N2与H2反应生成NH3的热化学方程式为____________________________。
(3)钛(Ti)被称为继铁、铝之后的第三金属,已知由金红石(TiO2)制取单质Ti,涉及的步骤为: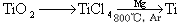
已知:①C(s)+O2(g) 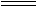 CO2(g); ΔH=-395.5 kJ·mol-1
CO2(g); ΔH=-395.5 kJ·mol-1
②2CO(g)+O2(g) 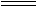 2CO2(g); ΔH=-560 kJ·mol-1
2CO2(g); ΔH=-560 kJ·mol-1
③TiO2(s)+2Cl2(g)+2C(s) 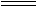 TiCl4(s)+2CO(g)的ΔH=―80kJ/mol
TiCl4(s)+2CO(g)的ΔH=―80kJ/mol
则TiO2(s)与Cl2(g)反应的热化学方程式为 。
(13分)
(1)C2H2(g)+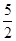 O2(g)=2CO2(g)+ H2O(l) ΔH=-1125 kJ/mol (4分)
O2(g)=2CO2(g)+ H2O(l) ΔH=-1125 kJ/mol (4分)
(2)N2(g)+ 3H2(g)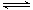 2NH3(g) ΔH=-122 kJ/mol (4分)
2NH3(g) ΔH=-122 kJ/mol (4分)
(3)TiO2(s)+ 2Cl2(g)=TiCl4(s)+ O2(g) ΔH=+151 kJ/mol (5分)
题目分析:(1)乙炔分子中碳元素的化合价是-1价,反应后变为+4价,失去5个电子,即1mol乙炔失去10mol电子,则每有4NA个电子转移时,消耗乙炔的物质的量是0.4mol,所以每消耗1mol乙炔放出的热量是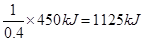 ,因此该反应的热化学方程式是C2H2(g)+
,因此该反应的热化学方程式是C2H2(g)+ 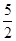 O2(g)=2CO2(g)+ H2O(l) ΔH=-1125 kJ/mol。
O2(g)=2CO2(g)+ H2O(l) ΔH=-1125 kJ/mol。
(2)反应热就是断键吸收的能量,和形成化学键所放出的能量的差值,则根据键能可知,每生成2mol氨气的反应热△H=436kJ/mol×3+940kJ/mol-2×3×395kJ/mol=-122 kJ/mol,即反应的热化学方程式是N2(g)+ 3H2(g)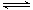 2NH3(g) ΔH=-122 kJ/mol。
2NH3(g) ΔH=-122 kJ/mol。
(3)根据盖斯定律可知,③+②-①×2,即得到反应TiO2(s)+ 2Cl2(g)=TiCl4(s)+ O2(g) ,所以该反应的反应热ΔH=―80kJ/mol-560 kJ/mol+395.5 kJ/mol×2=+151 kJ/mol。


 [Fe2(OH)n(SO4) 3-n/2 ] m,则水解反应的化学方程式为 。
[Fe2(OH)n(SO4) 3-n/2 ] m,则水解反应的化学方程式为 。