工业上合成氨的热反应方程式如下:N2(g)+3H2(g) 2NH3(g) △H=-92 kJ/mol
2NH3(g) △H=-92 kJ/mol
(1)若已知破坏1mol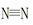 键、H—H键键分别需吸收的能量为946 kJ、436 kJ,则断开1molN—H需吸收的能量为 kJ。
键、H—H键键分别需吸收的能量为946 kJ、436 kJ,则断开1molN—H需吸收的能量为 kJ。
(2)在恒温恒压的条件下,将2mol N2和6molH2通入一容积可变的容器中反应,达到平衡后气体的体积为反应前的75%,则该过程释放的能量为 kJ,氮气的转化率为 ,平衡后氨气占混合气体的体积分数为 。
(3)若将1mol N2和1molH2通入两个相同体积的密闭容器甲和乙中,甲容器保持温度和体积不变,乙容器保持温度和压强不变,经过一段时间后,两容器均达到平衡状态。
①建立平衡所需的时间:甲 乙(填“>”,“<”或“=”)
②达到平衡后氨气的体积分数:甲 乙(填“>”,“<”或“=”)
(1) 391(2) 92;50%; 或33.3% (3)① > ② <
或33.3% (3)① > ② <
题目分析:(1)因反应热等于反应物的总键能减去生成物的总键能,设N-H键能为 xkJ/mol,则945.6kJ/mol+3×436 kJ/mol-6×x kJ/mol=-92.2kJ/mol,解得x=391。
(2) N2(g)+3H2(g) 2NH3(g)
2NH3(g)
起始量(mol) 2 6 0
转化量(mol) x 3x 2x
平衡量(mol) 2-x 6-3x 2x
则根据达到平衡后气体的体积为反应前的75%可知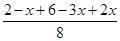 =0.75
=0.75
解得x=1
所以该过程释放的能量为92kJ
氮气的转化率为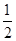 ×100%=50%
×100%=50%
平衡后氨气占混合气体的体积分数为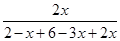 =
=
(3)①根据方程式N2(g)+3H2(g) 2NH3(g)可知,正方应是体积减小的可逆反应,所以如果保持容积不变,则压强降低,这说明在反应过程中乙容器中的压强始终大于甲容器中的压强。压强大,反应速率快,到达平衡的时间少,即建立平衡所需的时间:甲>乙。
2NH3(g)可知,正方应是体积减小的可逆反应,所以如果保持容积不变,则压强降低,这说明在反应过程中乙容器中的压强始终大于甲容器中的压强。压强大,反应速率快,到达平衡的时间少,即建立平衡所需的时间:甲>乙。
②正方应是体积减小的可逆反应,因此压强大有利于平衡向正反应方向移动,氨气的体积分数增大,所以达到平衡后氨气的体积分数:甲<乙。
