甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
②某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(l) ΔH1=-1451.6kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2=-566.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置:
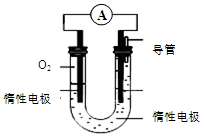
①该电池的能量转化形式为 。
②该电池正极的电极反应为 。
③工作一段时间后,测得溶液的pH减小,则该电池总反应的化学方程式为 。
(1)①<(2分) ②80%(2分) 250℃(2分)
(2)CH3OH(l) + O2(g) = CO(g) + 2H2O(l) ΔH1=-442.8kJ/mol(3分)
⑶①化学能转化为电能(2分)
②O2 + 2H2O +4e- = 4OH-(2分)
③2CH3OH + 3O2 + 4OH-= 2CO32-+ 6H2O(3分
题目分析:(1)①由题给数据分析,随着温度的升高,平衡常数减小,平衡向逆向移动,升温平衡向吸热方向移动,该反应正向为放热反应,ΔH1<0;②利用三行式进行计算。按反应II充分反应,达到平衡后,测得c(CO)=0.2mol/L,设转化的CO的物质的量浓度为x,
CO(g)+2H2 (g) CH3OH (g)
CH3OH (g)
起始量(mol/L) 1 3 0
变化量(mol/L) x 2x x
平衡量(mol/L) 0.2 3-2x x
分析知x=0.8mol/L
平衡时各物质的浓度:c(CO)=0.2mol/L,c(H2)=1.4mol/L,c(CH3OH)=0.8mol/L;一氧化碳的转化率=0.8/1×100%=80%,K=0.8/0.2×1.42=2.041,由表格可知温度为250℃;(2)由盖斯定律,①-②得:2CH3OH(l)+2O2(g)═2CO(g)+4H2O(l),△H=-885.6 kJ∕mol,热化学反应方程式为:CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=-442.8 kJ∕mol;(3)①分析知此装置为甲醇燃料电池,该电池的能量转化形式为化学能转化为电能;②正极上氧气得电子和水反应生成氢氧根,所以其电极反应式为O2+2H2O+4e-═4OH-;③负极上甲醇失电子和氢氧根反应生成碳酸根和水,正极上氧气得电子和水反应生成氢氧根,所以其电池反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O。

 2NH3为放热反应,由此推断出 ( )
2NH3为放热反应,由此推断出 ( )