2012年始,雾霾天气无数次肆虐家乡邯郸。其中,燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0
①该反应平衡常数表达式
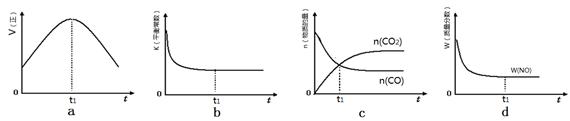
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
已知:Ⅰ CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
Ⅱ 2NO2(g)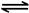 N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol
Ⅲ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: 。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mL1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).
①甲烷燃料电池的负极反应式: 。
②电解后溶液的pH= (忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是 L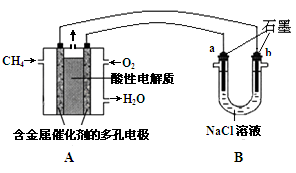
(1)①[CO2]2[ N2]/[ NO]2[CO]2② bd
(2)CH4(g)+N2O4(g) =N2(g) +2H2O(g) + CO2(g) △H= —898.1kJ/mol
(3)①CH4 —8e— + 2H2O =CO2 + 8H+ ②14 ③ 1.68L
题目分析:(1)①根据化学平衡常数的书写规律:生成物平衡浓度系数次幂的积比反应物平衡浓度系数次幂的积,写出[CO2]2[ N2]/[ NO]2[CO]2;②a、可逆反应达平衡后正、逆速率相等且不再变化,由图像知,t1时刻V正最大,随反应进行速率发生变化,未到达平衡,错误;b、该反应正反应为放热反应,随反应进行温度升高,化学平衡常数减小,到达平衡后,温度为定值,平衡常数不变,图象与实际符合,正确;c、t1时刻后二氧化碳、NO的物质的量发生变化,t1时刻未到达平衡状态,错误;d、随着反应的进行NO的质量分数逐渐减小,t1时刻NO的质量分数不变,处于平衡状态,正确;答案bd;
(2)已知:Ⅰ CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol Ⅱ 2NO2(g) N2O4(g) △H=-56.9 kJ/mol Ⅲ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol,根据盖斯定律,Ⅰ-Ⅱ+Ⅲ×2得CH4(g)+N2O4(g) =N2(g) +2H2O(g) + CO2(g) △H= —898.1kJ/mol;
N2O4(g) △H=-56.9 kJ/mol Ⅲ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol,根据盖斯定律,Ⅰ-Ⅱ+Ⅲ×2得CH4(g)+N2O4(g) =N2(g) +2H2O(g) + CO2(g) △H= —898.1kJ/mol;
(3)①甲烷燃料电池中甲烷在负极发生氧化反应酸性条件下生成CO2-和H2O,负极电极反应式为CH4 —8e— + 2H2O =CO2 + 8H+ ,②根据题意知,n(NaCl)=0.1mol该电解过程为先电解饱和食盐水,后电解水,根据电解方程式2Cl- + 2H2O  H2↑ + Cl2↑ + 2OH-,代入数据计算得n(OH-)=0.1mol,浓度为1mol/L,电解后溶液的pH=14;③n(NaCl)=0.1mol,电解产生氯气的物质的量为0.05mol,根据题意该电解过程为先电解饱和食盐水,后电解水,电极反应式为2H+ + 2e-=H2↑ 2Cl- - 2e-=Cl2↑ 4OH- - 4e-=O2↑ + 2H2O,阴极产生的氢气的物质的量为0.1mol,根据电子守恒可得:2n(H2)=2n(Cl-)+4n(O2)代入数据计算得n(O2)=0.025mol,阳极 * * 生气体0.075mol,体积为1.68L。
H2↑ + Cl2↑ + 2OH-,代入数据计算得n(OH-)=0.1mol,浓度为1mol/L,电解后溶液的pH=14;③n(NaCl)=0.1mol,电解产生氯气的物质的量为0.05mol,根据题意该电解过程为先电解饱和食盐水,后电解水,电极反应式为2H+ + 2e-=H2↑ 2Cl- - 2e-=Cl2↑ 4OH- - 4e-=O2↑ + 2H2O,阴极产生的氢气的物质的量为0.1mol,根据电子守恒可得:2n(H2)=2n(Cl-)+4n(O2)代入数据计算得n(O2)=0.025mol,阳极 * * 生气体0.075mol,体积为1.68L。
