由于催化剂可以为化学工业生产带来巨大的经济效益,催化剂研究和寻找一直是受到重视的高科技领域。
(1)V2O5是接触法制硫酸的催化剂。下图为硫酸生产过程中2SO2 (g) + O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1反应过程的能量变化示意图。
2SO3(g) ΔH=-196.6 kJ·mol-1反应过程的能量变化示意图。

①V2O5的使用会使图中B点 (填“升高”、“降低”)。
②一定条件下,SO2与空气反应tmin后,SO2和SO3物质的量浓度分别为a mol/L和b mol/L,则SO2起始物质的量浓度为 mol/L;生成SO3的化学反应速率为 mol/(L·min)。
(2)下图是一种以铜、稀硫酸为原料生产蓝矾的生产流程示意图。
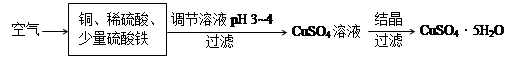
①生成CuSO4的总反应为2Cu+O2+2H2SO4=2 CuSO4+2H2O,少量 起催化作用,使反应按以下两步完成:
起催化作用,使反应按以下两步完成:
第一步:Cu+2Fe3+=2Fe2++Cu2+
第二步: 。(用离子方程式表示)
②调节溶液pH为3~4的目的是 ,调节时加入的试剂可以为 。(选填序号)
a.NaOH溶液 b.CuO粉末 c.Cu2(OH)2CO3 d.氨水
(3)纳米TiO2是优良的光敏催化剂。工业上用钛铁矿制得粗TiO2;再转化为TiCl4(l);由TiCl4(l)制取纳米TiO2的方法之一是将TiCl4气体导入氢氧火焰中(700~1000℃)进行水解。
已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
①写出TiO2和焦炭、氯气反应生成TiCl4和CO的热化学方程式: 。
②写出上述TiCl4(l)制取纳米TiO2的化学方程式: 。
(1)①降低(1分) ②a+b(1分) 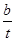 (1分) (2) ①4Fe2++O2+4H+=4Fe3++2H2O (2分)
(1分) (2) ①4Fe2++O2+4H+=4Fe3++2H2O (2分)
②将Fe3+转化为Fe(OH)3沉淀除去(1分) b,c(2分)
(3)①TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g) ΔH=-81 kJ·mol-1(2分)
②TiCl4+2H2O TiO2+4HCl(2分)
TiO2+4HCl(2分)
题目分析:(1)①催化剂能降低反应的活化能,所以V2O5的使用会使图中B点降低。
②一定条件下,SO2与空气反应tmin后,SO2和SO3物质的量浓度分别为a mol/L和b mol/L,则根据S原子守恒可知,SO2起始物质的量浓度为(a+b)mol/L;反应速率通常用单位时间内浓度的变化量来表示,所以生成SO3的化学反应速率为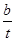 mol/(L·min)。
mol/(L·min)。
(2)①由于催化剂在反应前后不变,因此根据总反应式和第一步反应式可知,总反应式减去第一步反应式即得到第二步反应式,即第二步反应式为4Fe2++O2+4H+=4Fe3++2H2O
②由于溶液中含有铁离子,会干扰硫酸铜的制备,因此需要将铁离子除去。所以调节溶液pH的目的就是将Fe3+转化为Fe(OH)3沉淀除去。又因为在除去铁离子的同时,不能在引入新的杂质,因此不能 选择氢氧化钠和氨水,应该选择氧化铜或碱式碳酸铜,即答案选bc。
(3)①已知反应①TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1、②2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1,则根据盖斯定律可知①+②即得到反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g),所以该反应的反应热ΔH=140 kJ·mol-1-221 kJ·mol-1=-81 kJ·mol-1。
②根据TiCl4(l)制取纳米TiO2的方法之一是将TiCl4气体导入氢氧火焰中(700~1000℃)进行水解可知,TiCl4(l)制取纳米TiO2的化学方程式为TiCl4+2H2O TiO2+4HCl。
TiO2+4HCl。
