化学反应原理在工业生产中具有十分重要的意义。
(1)工业生产可以用NH3(g)与CO2(g)经过两步反应生成尿素,两步反应的能量变化示意图如下:
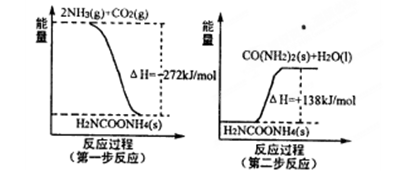
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为 。
(2)已知反应Fe(s) +CO2(g)  FeO(s) +CO(g) ΔH ="a" kJ/mol
FeO(s) +CO(g) ΔH ="a" kJ/mol
测得在不同温度下,该反应的平衡常数K随温度的变化如下:

①该反应的化学平衡常数表达式K= ,a 0(填“>”、“<”或“=”)。在500℃ 2L密闭容器中进行反应,Fe和CO2的起始量均为4 mol,则5 min后达到平衡时CO2的转化率为 ,生成CO的平均速率v(CO)为 。
②700℃反应达到平衡后,要使该平衡向右移动,其他条件不变时,可以采取的措施有
(填字母)。
A.缩小反应器容积
B.增加Fe的物质的量
C.升高温度到900℃
D.使用合适的催化剂
(1)2NH3(g)+CO2(g)⇌H2O(l)+H2NCONH2(s)△H=-134kJ•mol-1;(2)c(CO)/c(CO2);>;50%;0.2mol/(Lmin);C。
题目分析:(1)第一步:2NH3(g)+CO2(g)⇌H2NCOONH4(l,氨基甲酸铵)△H1=-272KJ/mol,第二步:H2NCOONH4(l)⇌H2O(l)+H2NCONH2(s)△H2=138KJ/mol,根据盖斯定律,两个过程相加得到NH3(g)与CO2(g)反应生成尿素的热化学方程式为2NH3(g)+CO2(g)⇌H2O(l)+H2NCONH2(s)△H=-134kJ•mol-1;(2)①反应Fe(s)+CO2(g)═FeO(s)+CO(g)的平衡常数k=c(CO)/c(CO2)
,由表中数据可知,对于反应①,温度越高平衡常数越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应进行,故a>0,
令平衡时参加反应的二氧化碳的物质的量为xmol,则:
Fe(s)+CO2(g)═FeO(s)+CO(g)
开始(mol):4 0
变化(mol):x x
平衡(mol):4-x x
所以x/4−x=1解得x=2,故二氧化碳的转化率为2/4×100%=50%,故CO表示的平均速率v(CO)=2mol
/2L×5min=0.2mol/(L•min)。②A、缩小反应器容积,压强增大,化学平衡不移动,故A错误;B.增加Fe的物质的量,不会引起化学平衡的移动,故B错误;C.升高温度到900℃,化学平衡正向移动,故C正确;D.使用合适的催化剂,不会引起化学平衡的移动,故D错误。

