甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g)+3H2(g) CH3OH(g)+ H2O(g) ΔH2
CH3OH(g)+ H2O(g) ΔH2
①上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”).
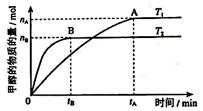
②在其他条件不变得情况下,考察温度对反应II的影响,实验结果如图所示
由图中数据判断 ΔH2 0 (填“>”,“=”或“<”).
③某温度下,将2 mol CO2和6 mol H2充入2L的密闭容器中,发生反应II,达到平衡后,测得c(CO2)= 0.2 mol/L, 则此时容器中的压强为原来的 倍
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH =-44.0 kJ/mol
请计算1 mol甲醇不完全燃烧生成1 mol一氧化碳和液态水放出的热量为 。
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.
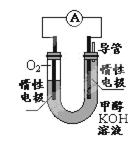
①该电池负极的电极反应为
②此电池消耗甲醇1.6克时,反应中电子转移数目为
③若以此燃料电池为铅蓄电池充电,则应将图中右侧电极连接蓄电池的 (填正极或负极)
(1) ① I ② < ③ 0.6 (2)442.8 KJ (3)CH3OH+8OH- -6e- = CO32- +6H2O0.3NA 负极
题目分析:(1)原子经济就是反应物的原子全部转化为生成物。选择反应I的化合反应。由图可知:T2>T1。升高温度甲醇的物质的量减少,说明升高温度化学平衡向逆反应方向移动。根据平衡移动原理:升高温度化学平衡向吸热反应方向移动。即逆反应方向是吸热反应,所以正反应是放热反应。故△H2<0.③反应开始时C(CO2)="1mol/L," C(H2)=3mol/L由于达到平衡后,测得c(CO2)= 0.2 mol/L,CO2改变浓度是0.8mol/L,所以H2改变浓度为2.4mol/L. H2平衡浓度为0.6mol/L.产生的甲醇、水蒸汽的浓度都是0.8mol/L.平衡时总浓度是2.4mol/L,而开始时总浓度是4mol/L。所以这时的压强是开始的2.4mol/L÷4mol/L=0.6倍。(2)①-②+③×4得:2CH3OH(l) + 2O2(g) =" 2CO" (g) + 4H2O(l) ΔH =-1275.6 kJ/molΔH =-885.6 kJ/mol。所以产生1mol一氧化碳和液态水放出的热量为442.8 KJ.(3)甲醇燃料电池的负极是通入甲醇的电极,电极反应为CH3OH+8OH- -6e- = CO32- +6H2O。每摩尔的甲醇反应转移电子9摩尔。消耗甲醇1.6克时,n(CH3OH)=1.6g÷32g/mol=0.05mol,所以转移电子0.3 NA。③若以此燃料电池为铅蓄电池充电,则应将图中右侧电极连接蓄电池的负极。
