碳、氮和铝的单质及其化合物在工农业生产和生活中有重要作用。
(1)真空碳热还原一氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
2Al2O3(s)+ 2AlCl3(g)+ 6C(s)=6AlCl(g)+ 6CO(g);△H= a kJ•mol-1
3AlCl(g)= 2Al(l)+ AlCl3(g);△H= b kJ•mol-1
反应Al2O3(s)+ 3C(s)= 2Al(l)+ 3CO(g)的△H= kJ•mol-1
(用含a、b的代数式表示)。
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+ 2NO(g)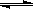 N2(g)+ CO2(g);△H= Q kJ•mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+ CO2(g);△H= Q kJ•mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间(min) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①0~10min内,NO的平均反应速率v(NO)= ,T1℃时,该反应的平衡常数K=
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)
a.通入一定量的NO b.加入一定量的活性炭
c.加入合适的催化剂 d.适当缩小容器的体积
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q 0(填“>”或“<”)。
④在恒容绝热条件下,能判断该反应一定达到化学平衡状态的依据是 (填选项编号)
a.单位时间内生成2nmol NO(g)的同时消耗nmol CO2(g)
b.反应体系的温度不再发生改变
c.混合气体的密度不再发生改变
(1)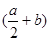 (1分)
(1分)
(2)① 0.032 mol/(L·min) (1分) 0.25(2分)
② a d (2分,多选错选不给分,漏选给1分)
③ <(2分)
④ b c (2分,多选错选不给分,漏选给1分)
题目分析:(1)根据盖斯定律,反应Al2O3(s)+ 3C(s)= 2Al(l)+ 3CO(g)可有方程式(1)×1/2+(2)得,因此代入相对应焓变值,得a/2+b;(2)①0~10min内,NO的平均反应速率v(NO)=(1-0.68)/10=0.032 mol/(L·min),T1℃时,在20min时各组分浓度不再发生变化,说明反应达到平衡,可得平衡常数为(0.25×0.25)/0.52=0.25;②30min后,只改变某一条件,反应重新达到平衡,各组分浓度都增加,可能是缩小体积或增加NO,加入碳是固体,或加入催化剂,平衡不移动,因此选ad;③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,相对原来的2:1:1,平衡向左移动,NO的量增加,根据升高温度,平衡向吸热反应方向移动,正反应是放热反应,Q<0,④在恒容绝热条件下,能判断该反应一定达到化学平衡状态,a.单位时间内生成2nmol NO(g),反应向逆反应方向进行,消耗nmol CO2(g),也是向逆向进行,不能表示平衡,错误;b.反应体系的温度不再发生改变,因为是绝热体系,所以当温度不再改变时,表示达到平衡,正确; c.混合气体的密度不再发生改变,体积不变,但碳是固体,当气体质量不再改变时,也就是密度不变,达到平衡,正确。
