问题
选择题
已知: 2H2(g) + O2(g) = 2H2O (l) △H=─571.6 kJ/mol,
CO(g)+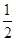 O2(g ) = CO2( g ) △H=─283.0 kJ / mol 。
O2(g ) = CO2( g ) △H=─283.0 kJ / mol 。
某H2和CO的混合气体完全燃烧时放出113.74kJ 热量,同时生成 3.6 g液态水,则原混合气体中H2和CO的物质的量之比为
A.2:1
B.1:2
C.1:1
D.2:3
答案
答案:C
题目分析:结合热化学方程式生成3.6g水时,消耗的氢气为0.2mol,同时放热57.16k J,则CO燃烧放热为113.74-57.16="56.58k" J,CO的物质的量为0.2mol,
