问题
选择题
已知:H2(g)+ O2(g)
O2(g) H2O(l)ΔH="-285.8" kJ/mol
H2O(l)ΔH="-285.8" kJ/mol
CH4(g)+2O2(g) CO2(g)+2H2O(l)ΔH="-890.3" kJ/mol
CO2(g)+2H2O(l)ΔH="-890.3" kJ/mol
现有H2和CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2(g)和H2O(l),共放出热量3 242.5 kJ,则原混合气体中H2和CH4的物质的量之比是( )
A.1∶1
B.1∶3
C.1∶4
D.2∶3
答案
答案:D
H2和CH4的混合气体112 L(标准状况),其物质的量为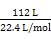 ="5" mol。设混合气体中含H2 x mol,则CH4(5-x)mol,则根据已知的热化学方程式可列方程:285.8x+890.3(5-x)="3" 242.5,解得x=2,故H2和CH4的物质的量之比为2∶(5-2)=2∶3,D项正确。
="5" mol。设混合气体中含H2 x mol,则CH4(5-x)mol,则根据已知的热化学方程式可列方程:285.8x+890.3(5-x)="3" 242.5,解得x=2,故H2和CH4的物质的量之比为2∶(5-2)=2∶3,D项正确。
