氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气燃烧热值高。实验测得,在常温常压下,1 g H2完全燃烧生成液态水,放出142.9 kJ热量。则H2燃烧热的化学方程式为 。
(2)氢气是合成氨的重要原料,合成氨反应的热化方程式如下:N2(g)+3H2(g) 2NH3(g);ΔH=-92.4 kJ/mol
2NH3(g);ΔH=-92.4 kJ/mol
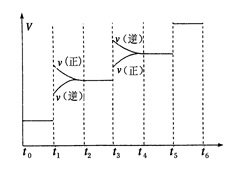
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。图中t1时引起平衡移动的条件可能是 其中表示平衡混合物中NH3的含量最高的一段时间是
②温度为T ℃时,将2 a mol H2和a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50%。则反应的平衡常数为
(1) H2(g)+ 1/2O2(g)=H2O(l);ΔH=-285.8 kJ/mol
(2)①增大压强 t2-t3 ②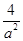
题目分析:(1)1g氢气的物质的量是0.5mol,燃烧0.5mol氢气放出142.9kJ热量,所以燃烧1mol氢气放出285.8kJ热量,所以氢气的燃烧热化学反应方程式为:H2(g)+1/2O2(g)=H2O(1)△H=-285.8kJ/mol;
(2)N2(g)+3H2(g)⇌2NH3(g);△H=-92.4kJ/mol;反应是放热反应,反应前后气体体积减小,①依据反应速率与时间的关系图象分析,t1时正逆反应速率都增大,平衡正向移动,引起平衡移动的条件可能是增大压强;表示平衡混合物中NH3的含量最高的一段时间是t2-t3;
② N2(g)+3H2(g)⇌2NH2(g)
开始 2amol/L 4amol/L 0
反应 amol/L 3amol/L 2amol/L
平衡 amol/L amol/L 2amol/L
所以化学平衡常数K=(2amol/L)2/(amol/L)•(amol/L)3=4/a2(L/mol)2,
