研究二氧化硫、氮氧化物、PM2.5等大气污染物的治理具有重要意义。
(1)对PM2.5样本用蒸馏水处理制成待测试样。若测得该试样中除H+和OH﹣外其它水溶性离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3﹣ | Cl﹣ |
| 浓度/mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断试样的pH =
(2)含SO2的工业废气处理:废气的将含有SO2的废气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,在废气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通一段时间的二氧化碳,以增加其脱硫效率;脱硫时控制浆液的pH值,此时浆液含有的亚硫酸氢钙可以被氧气快速氧化生成硫酸钙。
二氧化碳与石灰石浆液反应得到的产物为 。
亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式为 。
(3)汽车尾气中NOx和CO的生成及转化。
①已知气缸中生成NO的反应为:N2(g)+O2(g) 2NO(g)
2NO(g) 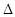 H>0
H>0
汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是 。
②在汽车尾气系统中安装催化转化器,使NO和CO迅速发生反应转化成对环境无污染的气体,可减少CO和NO的污染,反应的化学方程式为 。
(4)用CH4催化还原NOx可消除氮的氧化物的污染。例如:
CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g)△H=-574kJ·mol—1
CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ·mol—1
H2O(g)= H2O(l)△H=-144kJ·mol—1
取标准状况下4.48LCH4还原NO2和NO的混合物,若氮氧化物完全被还原,且生成H2O(l),则放出的总热量Q的取值范围是 。
(1)4 (3分)
(2)Ca(HCO3)2或碳酸氢钙(2分) Ca(HSO3)2 + O2 = CaSO4 + H2SO4(2分)
(3)①温度升高,反应速率加快,且平衡向正反应方向移动(2分)
②2CO + 2NO  2CO2 + N2 (2分)
2CO2 + N2 (2分)
(4)191kJ﹤Q﹤249.6kJ(4分)
题目分析:(1)观察表格中发现NH4+水解显酸性,PM2.5的酸碱性为酸性。试样的pH值根据溶液中电荷守恒计算H+离子浓度为10-4,PH值为4;
(2)CO2与CaCO3反应生成易溶的Ca(HCO3)2;亚硫酸氢钙具有还原性,可被氧化为硫酸钙,反应的方程式为Ca(HSO3)2 + O2 = CaSO4 + H2SO4;
(3)①气缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移;
②汽车尾气系统中装置反应的化学方程式为 2CO + 2NO  2CO2 + N2;
2CO2 + N2;
(4)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l)△H=-574kJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
③H2O(g)=H2O(l)△H=-44.0kJ•mol-1
由盖斯定律①+②+③×2得到:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l);△H="-1910" kJ•mol-1;
则热化学方程式为:④CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l);△H=-955 kJ•mol-1;
由盖斯定律②+③×2得到:⑤CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1248kJ•mol-1
标准状况下4.48LCH4物质的量为0.2mol,用极限法,如果全部按照④,放出热量191kJ,如果全部按照⑤,放出热量249.6kJ,所以Q的取值范围是191kJ﹤Q﹤249.6kJ。
