中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
(1)有效减碳的手段之一是节能,下列制氢方法最节能的是 。
A.电解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O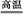 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O CO+3H2
CO+3H2
(2)CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH="-49.0" kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH="-49.0" kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。

①从3 min到9 min,v(H2)= mol/(L·min)。
②能说明上述反应达到平衡状态的是 (填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)工业上,CH3OH也可由CO和H2合成。参考合成反应CO(g)+2H2(g) CH3OH(g)的平衡常数:
CH3OH(g)的平衡常数:
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×1 | 2.4×1 | 1×1 |
下列说法正确的是 。
A.该反应正反应是放热反应
B.该反应在升高温度时,CH3OH(g)的体积分数减小,说明v正(CH3OH)减小,v逆(CH3OH)增大
C.在T ℃时,1 L密闭容器中,投入0.1 mol CO和0.2 mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5 Mpa)和250 ℃,是因为此条件下,原料气转化率最高
(1)C(3分) (2)①0.125(2分) ②D(3分)
(3)AC(4分)
(1)电解和高温都需要消耗大量能源,太阳光催化分解水制氢最节能。(2)①根据图像可知,从3 min到9 min内CO2减少了0.25 mol/L,所以H2减少了0.75 mol/L,故v(H2)=0.125mol/(L·min)。②在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,故D对;平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,故A错;密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,故B错;选项C中反应速率的方向是相同的,由于速率之比是相应的化学计量数之比,因此C中的关系始终成立,不正确。(3)根据表中数据可知,随着温度的升高,K值是逐渐减小的,这说明升高温度,平衡向逆反应方向移动,因此正反应是放热反应,选项A正确;升高温度,v正(CH3OH)和v逆(CH3OH)均增大,选项B不正确;平衡时CO、氢气、甲醇的浓度分别是(mol/L)0.05、0.1、0.05,所以平衡常数K=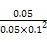 =100,选项C正确;由于正反应是放热的,因此升高温度不利于反应物的转化,故D错,答案选AC。
=100,选项C正确;由于正反应是放热的,因此升高温度不利于反应物的转化,故D错,答案选AC。
