2013年初,雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
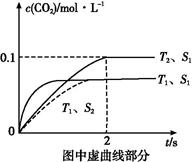
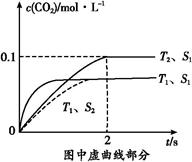
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)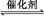 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
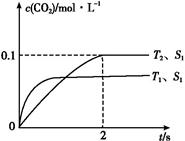
据此判断:
①该反应的ΔH 0(填“>”或“<”)。
②在T2温度下,0~2 s内的平均反应速率v(N2)= 。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
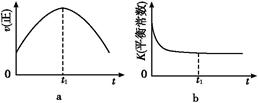
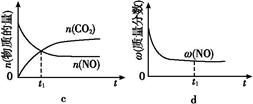
④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
例如:
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH1="-867" kJ/mol
N2(g)+CO2(g)+2H2O(g) ΔH1="-867" kJ/mol
2NO2(g) N2O4(g) ΔH2="-56.9" kJ/mol
N2O4(g) ΔH2="-56.9" kJ/mol
写出CH4(g)催化还原N2O4(g)生成N2(g)和H2O(g)的热化学方程式: 。
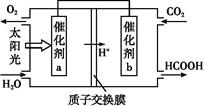
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应式为 。
(1)①< ②0.025 mol/(L·s)
③
④bd
(2)①CH4(g)+N2O4(g) N2(g)+CO2(g)+2H2O(g) ΔH="-810.1" kJ/mol
N2(g)+CO2(g)+2H2O(g) ΔH="-810.1" kJ/mol
②CO2+2H++2e- HCOOH
HCOOH
(1)③温度越高反应速率越大,催化剂接触面积越大反应速率越大,反应到达平衡的时间越短。
④a.反应达到平衡状态时,各物质的反应速率不再变化,故错误。b.该反应在绝热、恒容的密闭体系中进行,相当于升高温度,当温度不变时,化学平衡常数不变,故正确。c.二氧化碳和一氧化氮的物质的量相等时,该反应不一定达到平衡状态,故错误。d.反应达到平衡状态时,各物质的质量分数不再发生变化,故正确。
(2)①将第一个方程式减第二个方程式得:
CH4(g)+N2O4(g) N2(g)+CO2(g)+2H2O(g) ΔH="-810.1" kJ/mol。
N2(g)+CO2(g)+2H2O(g) ΔH="-810.1" kJ/mol。
②催化剂b表面上二氧化碳得电子和氢离子反应生成甲酸,所以发生的电极反应式为:
CO2+2H++2e- HCOOH。
HCOOH。
