煤制备CH4是一种有发展前景的新技术。
I. 煤炭气化并制备CH4包括以下反应:
C(s)+H2O(g)=CO(g)+H2 (g) ΔH 1 = +131 kJ/mol
CO(g) + H2O(g)=CO2 (g)+ H2(g) ΔH 2 = −41 kJ/mol
CO(g) + 3H2 (g)=CH4 (g)+ H2O(g) ΔH 3 = −206 kJ/mol
(1)写出煤和气态水制备CH4(产物还有CO2)的热化学方程式 。
(2)煤转化为水煤气(CO和H2)作为燃料和煤直接作为燃料相比,主要的优点有 。
(3)写出甲烷—空气燃料电池(电解质溶液为KOH溶液)中负极的电极反应式 。
II. 对以上反应CO(g) + H2O(g)  CO2 (g)+ H2(g) ΔH 2 = −41 kJ/mol,起始时在密闭容器中充入1.00 molCO和1.00 molH2O,分别进行以下实验,探究影响平衡的因素(其它条件相同且不考虑任何副反应的影响)。实验条件如下表:
CO2 (g)+ H2(g) ΔH 2 = −41 kJ/mol,起始时在密闭容器中充入1.00 molCO和1.00 molH2O,分别进行以下实验,探究影响平衡的因素(其它条件相同且不考虑任何副反应的影响)。实验条件如下表:
| 实验编号 | 容器体积/L | 温度/°C |
| ① | 2.0 | 1200 |
| ② | 2.0 | 1300 |
| ③ | 1.0 | 1200 |
(1)实验①中c(CO2)随时间变化的关系见下图,请在答题卡的框图中,画出实验②和③中c(CO2)随时间变化关系的预期结果示意图。
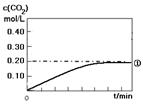
(2)在与实验①相同的条件下,起始时充入容器的物质的量:n(CO)=n(H2O)=n(CO2) =n( H2)=1.00mol。通过计算,判断出反应进行的方向。(写出计算过程。)
I.(1)2C(s)+ 2H2O(g)= CH4 (g)+ CO2 (g) ΔH = +15 kJ/mol (3分 )
(2)提高煤的利用率(节约能源或节约资源)(1分)、减少污染。(1分)
(3)CH4—8e-+10OH-=CO32-+7H2O(2分)
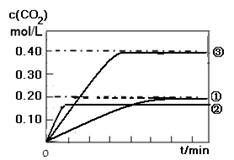
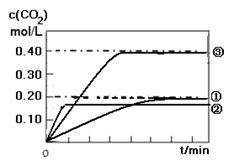
II. (1) 如图所示
(2)Q> K 反应向逆反应方向(生成CO和H2O的方向)进行 (1分)
题目分析: I. (1) 根据盖斯定律和已知方程式,煤和气态水制备甲烷的热化学方程式可由方程式①×2+②+③而得,所以ΔH=2ΔH 1+ ΔH 2+ΔH 3 = +15 kJ/mol ,所以热化学方程式为:2C(s)+ 2H2O(g)= CH4 (g)+ CO2 (g) ΔH = +15 kJ/mol 。
(2) 煤气化后生成水煤气再燃烧比直接燃烧煤更加充分,提高能源利用率,同时燃煤容易产生酸雨,所以燃烧水煤气还可以减少污染。
(3)用甲烷作燃料制成的碱性燃料电池中,甲烷失电子生成的CO2气体会与溶液中的碱性介质进一步反应生成CO32-,所以其负极的反应式为:CH4—8e-+10OH-=CO32-+7H2O。
II. (1) CO(g) + H2O(g)  CO2 (g)+ H2(g) 的反应是一个放热反应,所以温度升高,反应的反应速率加快,但使平衡逆向移动,实验②曲线比实验①曲线更快达到平衡,但是平衡时CO2的浓度要低一些;相比之下,实验③比试验①缩小了体积,即增大了压强,由于反应前后气体系数不变,所以增大压强只能增大化学反应速率,但是不能改变平衡,因此实验③的曲线比实验①更快达到平衡,且平衡时CO2的浓度是实验①的2倍。如图
CO2 (g)+ H2(g) 的反应是一个放热反应,所以温度升高,反应的反应速率加快,但使平衡逆向移动,实验②曲线比实验①曲线更快达到平衡,但是平衡时CO2的浓度要低一些;相比之下,实验③比试验①缩小了体积,即增大了压强,由于反应前后气体系数不变,所以增大压强只能增大化学反应速率,但是不能改变平衡,因此实验③的曲线比实验①更快达到平衡,且平衡时CO2的浓度是实验①的2倍。如图
(2)整体思路:先根据实验①充入的物质的物质的量和平衡时候CO2的浓度计算出在相同温度下的平衡常数K,然后比较此时的浓度商Q与实验①的K值的大小,从而得出反应进行的方向。
计算过程为:
(2) 平衡时n(CO2)=0.20mol/Lx2.0L=0.40mol
CO(g) + H2O(g)  CO2 (g)+ H2(g)
CO2 (g)+ H2(g)
起始物质的量/mol 1.00 1.00 1.00 1.00
变化物质的量/mol 0.40 0.40 0.40 0.40
平衡物质的量/mol 0.60 0.60 0.40 0.40 (1分)
K=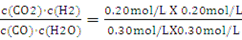 ="0.44" (2分)
="0.44" (2分)
Q=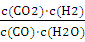 =
=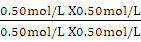 =" 1.0" (1分)
=" 1.0" (1分)
Q> K 反应向逆反应方向(生成CO和H2O的方向)进行 (1分)
