(1)新的《环境空气质量标准》(GB 3095 2012)将于2016年1月1日在我国全面实施。据此,环境空气质量指数(AQI)日报和实时报告包括了SO2、NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。
2012)将于2016年1月1日在我国全面实施。据此,环境空气质量指数(AQI)日报和实时报告包括了SO2、NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。
①汽车排出的尾气中含有CO和NO等气体,用化学方程式解释产生NO的原因 。
②汽车排气管内安装的催化转化器,可使汽车尾气中的主要污染物转化为无毒的大气循环物质。已知:
N2(g)+O2(g)="2NO(g)" ΔH="+180.5" kJ/mol
2C(s)+O2(g)="2CO(g)" ΔH="-221.0" kJ/mol
C(s)+O2(g)=CO2(g) ΔH="-393.5" kJ/mol
则反应2NO(g)+2CO(g)=N2(g)+2CO2(g)的ΔH= kJ/mol。
(2)直接排放氮氧化物会形成酸雨、雾霾,催化还原法和氧化吸收法是常用的处理方法。利用NH3和CH4等气体除去烟气中的氮氧化物。已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1="a" kJ/mol;欲计算反应CH4(g)+4NO(g)=CO2(g)+2H2O(l)+2N2(g)的焓变ΔH2则还需要查询某反应的焓变ΔH3,当反应中各物质的化学计量数之比为最简整数比时,ΔH3="b" kJ/mol,该反应的热化学方程式是 ,据此计算出ΔH2= kJ/mol(用含a、b的式子表示)。
(3)下表列出了工业上吸收SO2的三种方法。
| 方法Ⅰ | 用氨水将SO2转化(NH4)2SO3,再氧化成(NH4)2SO4 |
| 方法Ⅱ | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫 |
| 方法Ⅲ | 用Na2SO3溶液吸收SO2,再经电解转化为H2SO4 |
2CO(g)+SO2(g)=S(g)+2CO2(g) ΔH="+8.0" kJ/mol
2H2(g)+SO2(g)=S(g)+2H2O(g)ΔH="+90.4" kJ/mol
2CO(g)+O2(g)=2CO2(g) ΔH="-566.0" kJ/mol
2H2(g)+O2(g)=2H2O(g) ΔH="-483.6" kJ/mol
则S(g)与O2(g)反应生成SO2(g)的热化学方程式可表示为 。
(4)合成氨用的氢气可以甲烷为原料制得。有关化学反应的能量变化如图所示,则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。
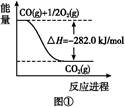
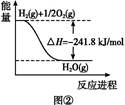
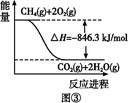
(1)①N2+O2 2NO ②-746.5
2NO ②-746.5
(2)N2(g)+O2(g)="2NO(g)" ΔH3="b" kJ/mol a-2b
(3)S(g)+O2(g)=SO2(g) ΔH="-574.0" kJ/mol
(4)CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH="+161.1" kJ/mol
(1)②按题干顺序给3个热化学方程式编号,由盖斯定律③×2-①-②得2NO(g)+2CO(g) N2(g)+2CO2(g)的ΔH="[-393.5×2-180.5-(-221.0)]kJ/mol=-746.5" kJ/mol。
N2(g)+2CO2(g)的ΔH="[-393.5×2-180.5-(-221.0)]kJ/mol=-746.5" kJ/mol。
(2)根据盖斯定律将已知的两个热化学方程式相减可得热化学方程式为2N2(g)+2O2(g)="4NO(g)" ΔH="a" kJ/mol-ΔH2="2b" kJ/mol,则ΔH2=(a-2b)kJ/mol,同时将上面的方程式及ΔH都除以2可得热化学方程式。
(3)将后面的两个方程式相加减去前两个方程式再除以2可得相应的热化学方程式:S(g)+O2(g)=SO2(g)ΔH="-574.0" kJ/mol。
(4)按题干顺序给图像中的3个热化学方程式编号,根据盖斯定律,③-②×3-①得CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH="[-846.3-(-241.8)×3-(-282.0)]kJ/mol=+161.1" kJ/mol。
