(1)已知:H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
H2(g)=H2(l) ΔH=-0.92 kJ·mol-1
O2(g)=O2(l) ΔH=-6.84 kJ·mol-1
H2O(l)=H2O(g) ΔH=+44.0 kJ·mol-1
请写出液氢和液氧反应生成气态水的热化学方程式:__________________________
电解质溶液为KOH溶液的氢氧燃料电池,其负极的电极反应式为____________________________________。
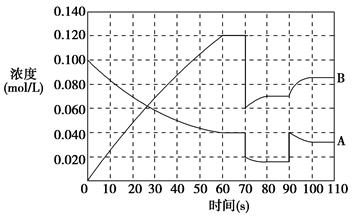
(2)如图表示373 K时,反应A(g) 2B(g)在前110 s内的反应进程。
2B(g)在前110 s内的反应进程。

①此反应的平衡常数表达式K=________。
②373 K时反应进行到70 s时,改变的条件可能是________,反应进行到90 s时,改变的条件可能是________。
A.加入催化剂
B.扩大容器体积
C.升高温度
D.增大A的浓度③请在图中画出反应物A在0~70 s时的浓度变化曲线。
(1)H2(l)+1/2O2(l)=H2O(g) ΔH=-237.46 kJ·mol-1
H2+2OH--2e-=2H2O
(2)①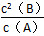 ②B D ③如图
②B D ③如图
本题综合考查化学反应原理内容,考查了盖斯定律的应用、化学平衡的移动、电极反应式的书写等知识,意在考查考生运用化学原理解决问题的能力。
(1)由盖斯定律,利用题给的热化学反应方程式推导可得要求的热化学方程式为H2(l)+1/2O2(l)=H2O(g) ΔH=-237.46 kJ·mol-1。
(2)②反应进行到70 s时B的浓度和A的浓度均降低为原来的1/2,且平衡移动时B的浓度逐渐增大,A的浓度逐渐减小,即平衡向右移动,可以判断改变的条件是扩大容器体积。反应进行到90 s时A的浓度突然增大,平衡移动时A的浓度逐渐变小,B的浓度逐渐变大,即平衡向右移动,可以判断改变的条件是增大A的浓度。③由图可以看出反应起始时B的浓度为0,进行到60 s时达到平衡状态,此时A的浓度为0.040 mol·L-1,B的浓度为
0.120 mol·L-1,由化学计量数关系知B的浓度变化量是A的浓度变化量的2倍,可以求出A的起始浓度为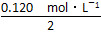 +0.040 mol·L-1=0.100 mol·L-1,可以画出对应曲线。
+0.040 mol·L-1=0.100 mol·L-1,可以画出对应曲线。
