Ⅰ.沿海地区有着丰富的海水资源,海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。合理利用资源和保护环境是可持续发展的重要保证。
 (1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出电解熔融氯化镁制取金属镁的化学反应方程式 。
(1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出电解熔融氯化镁制取金属镁的化学反应方程式 。
(2)某化工厂生产过程中会产生含有Cu2+和Pb2+的污水。排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入 (选填“Na2S”或“NaOH”)效果更好。
| 难溶电解质 | Cu(OH)2 | CuS | Pb(OH)2 | PbS |
| Ksp | 4.8×10-20 | 6.3×10-36 | 1.2×10-15 | 1.0×10-28 |
(3)火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题。利用海水脱硫是一种有效的方法,其工艺流程如下图所示:

①天然海水的pH≈8,试用离子方程式解释天然海水呈弱碱性的原因 (任写一个)。
②某研究小组为探究提高含硫烟气中SO2吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如图所示。
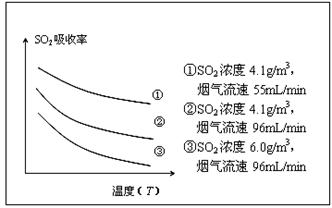
请你根据图示实验结果,就如何提高一定浓度含硫烟气中SO2的吸收效率,提出一条合理化建议: 。
③天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,使用氧气将其氧化的化学原理是 (任写一个化学方程式或离子方程式)。氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是 。
Ⅱ.能源是人类生存和发展的重要支柱。研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义。已知下列热化学方程式
①2H2(g)+O2(g)=2H2O(l) 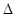 H=-570kJ/mol;
H=-570kJ/mol;
②H2(g)+1/2O2(g)=H2O(g) 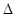 H=-242kJ/mol;
H=-242kJ/mol;
③C(s)+1/2O2(g)=CO(g) 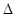 H=—110.5kJ/moL;
H=—110.5kJ/moL;
④C(s)+O2(g)=CO2(g) 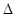 H=—393.5kJ/moL;
H=—393.5kJ/moL;
⑤CO2(g)+2H2O(g)=2CH4(g)+2 O2(g) 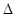 H=+890kJ/moL
H=+890kJ/moL
回答下列问题
(1)上述反应中属于吸热反应的是 。
(2)H2的燃烧热为△H= 。
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然难直接测定,但可通过间接的方法求得。已知C(s) + H2O(g)=H2(g)+ CO(g) 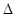 H=akJ/moL;则a= ;该反应的熵
H=akJ/moL;则a= ;该反应的熵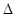 S 0(选填“>”、“=”、“<”);已知自由能
S 0(选填“>”、“=”、“<”);已知自由能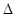 G=
G=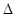 H—T
H—T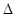 S,当
S,当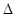 G<0时可自发进行。则该反应在什么条件下可自发进行__________________。
G<0时可自发进行。则该反应在什么条件下可自发进行__________________。
(4)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是 。
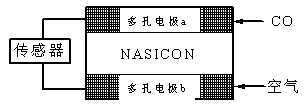
A.负极的电极反应式为:CO+O2—―2e-=CO2
B.工作时电极b作正极,O2—由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
(共15分)Ⅰ、(1) MgCl2(熔融) Mg+Cl2↑1分 (2) Na2S 1分
Mg+Cl2↑1分 (2) Na2S 1分
(3)①CO32-+H2O HCO3-+OH-或 HCO3-+H2O
HCO3-+OH-或 HCO3-+H2O H2CO3+OH- 1分
H2CO3+OH- 1分
②降低含硫烟气的温度(或减小含硫烟气的流速)。 1分
③2H2SO3+O2=4H++2SO42-(或2H2SO4)或2HSO3-+O2=2H++2SO42-;2分
中和、稀释经氧气氧化后海水中生成的酸(H+),减少污染。1分
Ⅱ、(1) ⑤ 1分 (2)-285kJ/mol 1分
(3)+131.5 2分 > 1分 高温 1分 (4)B 2分
题目分析:I、(1)镁是活泼的金属,冶炼时需要通过电解熔融的氯化镁进行,反应的化学方程式为MgCl2(熔融) Mg+Cl2↑。
Mg+Cl2↑。
(2)根据表中数据可知,氯化铜与硫化汞的溶度积常数分别远小于氢氧化铜与氢氧化汞的溶度积常数,所以沉淀剂最好选择硫化钠。
(3)①由于海水中含有CO32-、HCO3-等离子,二者均水解使海水显碱性,反应的离子方程式为CO32-+H2O HCO3-+OH-或 HCO3-+H2O
HCO3-+OH-或 HCO3-+H2O H2CO3+OH-。
H2CO3+OH-。
②根据图像可知,温度越高,SO2的吸收率越小。在温度相同时,烟气速率越小,SO2的吸收率越大,所以合理建议应该是降低含硫烟气的温度(或减小含硫烟气的流速)。
③由于H2SO3、HSO3-等分子或离子均具有还原性,易被氧化为SO42-,反应的离子方程式为2H2SO3+O2=4H++2SO42-(或2H2SO4)或2HSO3-+O2=2H++2SO42-;由于反应后溶液的酸性增强,所以氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸(H+),减少污染。
Ⅱ、(1)在热化学方程式中△H<0表示反应是放热反应,△H>0表示反应是吸热反应,所以上述反应中属于吸热反应的是⑤,其余均是放热反应。
(2)燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以H2的燃烧热为△H=-570kJ/mol÷2=-285kJ/mol。
(3)已知②H2(g)+1/2O2(g)=H2O(g) △H=-242kJ/mol;③C(s)+1/2O2(g)=CO(g) △H=—110.5kJ/moL,则根据盖斯定律可知③-②即得到C(s) + H2O(g)=H2(g)+ CO(g),所以该反应的反应热△H=—110.5kJ/moL+242kJ/mol=+131.5 kJ/mol,即a=+131.5。根据方程式可知,该反应是体积增大的,所以该反应的熵△S>0;根据△G=△H—T·△S可知,当△G<0时可自发进行。由于该反应的△S>0、△H>0,则该反应应该在高温条件下可自发进行。
(4)原电池中负极失去电子,发生氧化反应。正极得到电子,发生还原反应。所以在该燃料电池中CO再负极通入,空气在正极通入。A、CO在负极通入,则负极的电极反应式为:CO+O2—―2e-=CO2,A正确;B、工作时电极b作正极,由于原电池中阴离子向负极移动,所以O2—由电极b流向电极a,B不正确;C、原电池中电子从负极流向正极,所以工作时电子由电极a通过传感器流向电极b,C正确;D、传感器中通过的电流越大,消耗的CO越多,所以尾气中CO的含量越高,D正确,答案选B。
