CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130 ℃和180 ℃时,分别将0.50 mol CH4和a mol NO2充入1 L的密闭容器中发生反应,测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130 ℃和180 ℃时,分别将0.50 mol CH4和a mol NO2充入1 L的密闭容器中发生反应,测得有关数据如下表:
| 实验 编号 | 温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
| 1 | 130 ℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180 ℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | 0.15 |
(1)开展实验1和实验2的目的是______________________________。
(2)180 ℃时,反应到40 min,体系________(填“是”或“否”)达到平衡状态,理由是__________________________;
CH4的平衡转化率为________。
(3)已知130 ℃时该反应的化学平衡常数为6.4,试计算a的值。(写出计算过程)
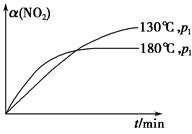
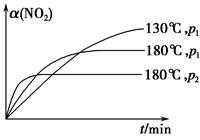
(4)一定条件下,反应时间t与转化率α(NO2)的关系如图所示,请在图像中画出180 ℃时,压强为p2(设压强p2>p1)的变化曲线,并做必要的标注。
(5)根据已知求算:ΔH2=________。
CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) ΔH2
2N2(g)+CO2(g)+2H2O(g) ΔH2
(1)探究温度对反应速率和化学平衡的影响
(2)是 温度升高,反应速率加快,高温下比低温下更快达到平衡状态,对比实验1可确定40 min时反应已经达到平衡状态 70%
(3) CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)
N2(g)+CO2(g)+2H2O(g)
c0/mol·L-1: 0.50 a 0 0 0
Δc/mol·L-1: 0.40 0.80 0.40 0.40 0.80
c平/mol·L-1: 0.10 a-0.80 0.40 0.40 0.80
则: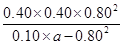 =6.4,解得a=1.2
=6.4,解得a=1.2
答:a的值为1.2
(4)
(5)-1 160 kJ·mol-1
(1)实验1和实验2相比只是改变了温度,因此实验目的是探究温度对反应速率和化学平衡的影响。(2)温度升高,该反应的反应速率加快,且平衡向逆反应方向移动,对比实验1可知40 min时,实验2中已经达到平衡状态。(4)正反应是气体体积增大的反应,增大压强,平衡向逆反应方向移动,NO2的转化率降低,而反应速率更快,图像如答案
