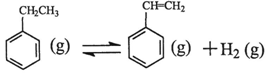
苯乙烯是现代石油化工产品中最重要的单体之一。在工业上,苯乙烯可由乙苯和CO2
催化脱氢制得。总反应原理如下:
 △H
△H
回答下列问题:
(1)乙苯在CO2气氛中的反应可分两步进行:
 △H1=+117.6kJ·mol-1
△H1=+117.6kJ·mol-1
H2 (g)+CO2 (g) CO (g)+H2O (g) △H2=+41.2kJ·mol-1
CO (g)+H2O (g) △H2=+41.2kJ·mol-1
由乙苯制取苯乙烯反应的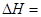 。
。
(2)在温度为T1时,该反应的平衡常数K=0.5mol/L。在2L的密闭容器中加入乙苯与CO2,反应到某时刻测得混合物中各组分的物质的量均为1.0mol。
①该时刻化学反应 (填“是”或“不是”)处于平衡状态;
②下列叙述能说明乙苯与CO2在该条件下反应已达到平衡状态的是 (填正确答案编号);
a.正、逆反应速率的比值恒定 b.c(CO2)=c(CO)
c.混合气体的密度不变 d.CO2的体积分数保持不变
③若将反应改为恒压绝热条件下进行,达到平衡时,则乙苯的物质的量浓度 (填正确答案编号)
A.大于0.5mol/L
B.小于0.5mol/L
C.等于0.5mol/L
D.不确定(3)在温度为T2时的恒容器中,乙苯、CO2的起始浓度分别为2.0mol/L和3.0mol/L,设反应平衡后总压强为P、起始压强为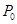 ,则反应达到平衡时苯乙烯的浓度为 , (均用含
,则反应达到平衡时苯乙烯的浓度为 , (均用含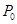 、P的表达式表示)。
、P的表达式表示)。
(4)写出由苯乙烯在一定条件下合成聚苯乙烯的化学方程式 。
(1)+158.8kJ·mol-1(2分)(2)①是(2分) ②abd (3分) ③d(2分)
(3)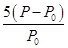 mol·L-1 (2分)
mol·L-1 (2分) 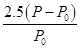 ×100%(2分)
×100%(2分)
(4)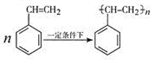 (2分)
(2分)
题目分析:(1)根据盖斯定律,两个方程式合并就得到乙苯制取苯乙烯反应的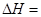 +158.8kJ·mol-1。
+158.8kJ·mol-1。
(2)①在2L的密闭容器中加入乙苯与CO2,反应到某时刻测得混合物中各组分的物质的量均为1.0mol,所以各组分的浓度都是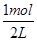 =0.5mol·L-1,QC=
=0.5mol·L-1,QC=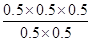 =0.5=K,所以该时刻化学反应是处于平衡状态;
=0.5=K,所以该时刻化学反应是处于平衡状态;
②ad两个选项都容易看出可以作为标志,要注意的是b,c(CO2)=c(CO)代表各组分的浓度相等,实际上就是①的情况,所以也可以说明是达到了平衡状态。c错,因为该反应实在在2L的密闭容器中加入乙苯与CO2,所以体积不变,根据质量守恒,气体的质量也不变,所以密度是一个定制,不能作为达到平衡的标志,所以c不能选。
③因为该反应前后系数不等,恒压就要扩大体积,平衡向正向移动,因为该反应正向是吸热反应,绝热要向逆向移动,所以恒压绝热两个因素都在变化,不确定向哪个方向移动,所以乙苯的物质的量浓度不能确定。
(3)三段法
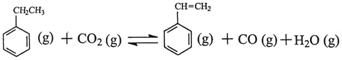
起始浓度 2.0 3.0 0 0 0
转化浓度 x x x x x
平衡浓度 2.0-x 3.0-x x x x
 =
=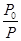
反应达到平衡时苯乙烯的浓度为x=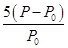 mol·L-1
mol·L-1
乙苯的转化率为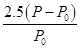 ×100%
×100%
(4)根据双键的性质,加聚反应的规律即可写出 。
。
