近年来我国汽车拥有量呈较快增长趋势,NOx是汽车尾气中的主要污染物之一。
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
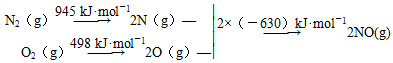
①写出该反应的热化学方程式:_________________________________________。
②随温度升高,该反应化学平衡常数的变化趋势是___________________________
(2)在汽车上安装高效催化转化器,可有效降低NOx的排放。某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂作用下反应2NO+2CO N2+2CO2 ΔH<0的反应速率。
N2+2CO2 ΔH<0的反应速率。
汽车尾气→尾气分析仪→催化反应器→尾气分析仪
用气体传感器测得不同时间NO和CO的浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(×10-4 mol·L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)(×10-3 mol·L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
①前2 s内的平均反应速率v(N2)=________。
②在该温度下,反应的平衡常数K=________L·mol-1(写出计算结果)。
③对于该可逆反应,通过综合分析以上信息,至少可以说明________(填字母)。
A.该反应的反应物混合后很不稳定
B.该反应一旦发生将在很短的时间内完成
C.该反应体系达到平衡时至少有一种反应物的百分含量较小
D.该反应在一定条件下能自发进行
E.该反应使用催化剂意义不大

(3)通过NOx传感器监测NOx的含量,其工作原理示意图如上图:
①Pt电极上发生的是__________反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式:________________________________________。
(1)①N2(g)+O2(g)=2NO(g) ΔH=+183 kJ·mol-1
②增大
(2)①1.88×10-4 mol/(L·s)②5000③BCD
(3)①还原②NO+O2--2e-=NO2
(1)①N2(g)+O2(g)=2NO(g) ΔH=945 kJ·mol-1+498 kJ·mol-1-2×630 kJ·mol-1=+183 kJ·mol-1。
②该反应为吸热反应,随温度升高,化学平衡常数增大。
(2)①v(N2)=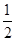 v(NO)=
v(NO)=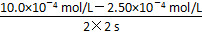 =1.875×10-4 mol/(L·s)≈1.88×10-4 mol/(L·s)。
=1.875×10-4 mol/(L·s)≈1.88×10-4 mol/(L·s)。
②2NO + 2CO N2 + 2CO2
N2 + 2CO2
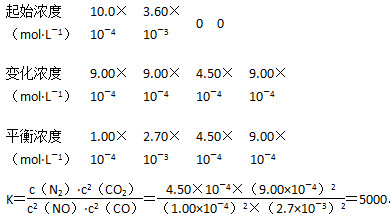
。
③该反应在催化剂存在时反应速率很快,所以反应一旦发生将在很短的时间内完成,但不能说明NO和CO混合后很不稳定,A项错误、B项正确;该反应的化学平衡常数大,所以反应达到平衡时至少有一种反应物的百分含量较小,C项正确;该反应是一个熵减的放热反应,所以一定条件下能自发进行,D项正确;使用高效催化剂能大大加快化学反应速率,故E项错误。
(3)Pt电极上O2得电子发生还原反应,电极反应式为O2+4e-=2O2-,电池总反应式为2NO+O2=2NO2,将电池总反应式减去Pt电极的电极反应式并化简得NiO电极的电极反应式:NO+O2--2e-=NO2
