下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
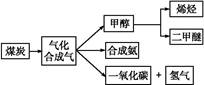
Ⅰ.已知该产业链中某反应的平衡常数表达式为:K=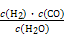 ,写出它所对应反应的化学方程式:
,写出它所对应反应的化学方程式:
。
Ⅱ.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用。工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0 MPa,温度230~280 ℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
ΔH1="-90.7" kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
ΔH2="-23.5" kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
ΔH3="-41.2" kJ·mol-1
(1)写出催化反应室中三个反应的总反应的热化学方程式: 。
(2)在某温度下,2 L密闭容器中发生反应①,起始时CO、H2的物质的量分别为2 mol和6 mol,3 min后达到平衡,测得CO的转化率为60%,则3 min内CO的平均反应速率为 。若同样条件下起始时CO物质的量为4 mol,达到平衡后CH3OH为2.4 mol,则起始时H2为 mol。
(3)下列有关反应③的说法正确的是 。
A.在体积可变的密闭容器中,在反应③达到平衡后,若加压,则平衡不移动、混合气体平均相对分子质量不变、混合气体密度不变
B.若830 ℃时反应③的K=1.0,则在催化反应室中反应③的K>1.0
C.某温度下,若向已达平衡的反应③中加入等物质的量的CO和H2O(g),则平衡右移、平衡常数变大
(4)为了寻找合适的反应温度,研究者进行了一系列实验,每次实验保持原料气组成、压强、反应时间等因素不变,实验结果如图,
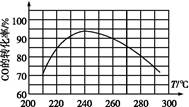
则CO转化率随温度变化的规律是 。
其原因是 。
Ⅰ.C(s)+H2O(g) CO(g)+H2(g)
CO(g)+H2(g)
Ⅱ.(1)3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)
CH3OCH3(g)+CO2(g)
ΔH="-246.1" kJ·mol-1
(2)0.2 mol·L-1·min-1 8.4 (3)B
(4)温度低于240 ℃时,CO的转化率随着温度的升高而增大;温度高于240 ℃时,CO的转化率随着温度的升高而减小
在相等的时间里,在较低温时,各反应体系均未达到平衡,CO的转化率主要受反应速率影响,随着温度的升高反应速率增大,CO的转化率也增大;在较高温时,各反应体系均已达到平衡,CO的转化率主要受反应限度影响,随着温度的升高平衡向逆反应方向移动,CO的转化率减小
Ⅰ.生成物中有CO,根据原子守恒,反应物中有固体C,
C(s)+H2O(g) H2(g)+CO(g)。
H2(g)+CO(g)。
Ⅱ.(1)①×2+②+③得到
3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)
CH3OCH3(g)+CO2(g)
ΔH="-246.1" kJ·mol-1。
(2)CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
起始浓度(mol·L-1) 1 3 0
转化浓度(mol·L-1) 0.6 1.2 0.6
平衡浓度(mol·L-1) 0.4 1.8 0.6
v(CO)=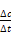 =
=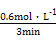 ="0.2" mol·L-1·min-1。
="0.2" mol·L-1·min-1。
设起始时H2浓度为x mol·L-1,
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
起始浓度(mol·L-1) 2 x 0
转化浓度(mol·L-1) 1.2 2.4 1.2
平衡浓度(mol·L-1) 0.8 x-2.4 1.2
条件不变,平衡常数不变:
 =
=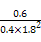 ,
,
x=4.2,
则起始时加入的H2的物质的量为:
4.2 mol·L-1×2 L="8.4" mol。
(3)反应③是一个反应前后气体体积不变的反应,加压、容器体积减小,平衡不移动,混合气体平均相对分子质量不变,混合气体密度增大,A错;催化反应室中温度230~280 ℃,低于830 ℃,利于反应正向进行,K增大,K>1.0,B正确;温度不变,平衡常数不变,C错。
